La fistule anale cryptogénique
Objectifs pédagogiques
- Connaitre la pathogénie et l’histoire naturelle des suppurations anales,
- Comment mener un examen proctologique,
- Place des examens complémentaires, quand les demander ?
- Base du traitement conventionnel et ses alternatives
Introduction
La fistule anale cryptogénique est une maladie proctologique fréquente pouvant représenter jusqu’à 71% des suppurations de la région (1). Il existe une prédominance masculine, avec une incidence en Finlande évaluée à 12,3 pour 100 000 chez l’homme et à 5,6 pour 100 000 chez la femme (2).
Etiopathogénie
La suppuration prend source au niveau de la glande d’Hermann et Desfosses située sur la ligne pectinée au creux d’une crypte. Le canal glandulaire s’abouche au niveau des cryptes mais le corps de la glande traverse le sphincter interne, la couche longitudinale voir parfois le sphincter externe (3). Ces glandes sont au nombre de 6 à 8, plus nombreuses dans la partie postérieure du canal anal. La fistule anale de l’enfant, quasiment inexistante chez la petite fille, serait du à des anomalies congénitales de ces glandes mais chez l’adulte l’origine reste inconnue. L’anatomie de ces glandes explique par contre l’évolution de la suppuration vers la fistule.
Cette évolution se fait en 2 phases : une première phase aigue l’abcès et une 2è phase chronique la fistule anale. En phase aigue, l’abcès peut-être intramural si l’infection reste circonscrite au sphincter interne et à l’espace intersphinctérien. Lorsque la suppuration traverse le sphincter externe, elle s’extériorise au niveau de la peau, réalisant alors l’abcès marginal. L’abcès de la marge anal est donc une suppuration qui prend déjà la forme d’une fistule anale et on verra plus loin que son traitement doit s’attacher à mettre à plat ou drainer l’ensemble de ce trajet et non pas uniquement la partie extrasphinctérienne.
A la phase chronique, l’inflammation s’organise, la fibrose apparait et c’est un véritable trajet transphinctérien qui se forme avec :
- Un orifice interne sur la ligne pectinée, au niveau de la glande d’Hermann et Desfosses concernée
- Un orifice externe, le plus souvent sur la fesse en regard de l’orifice interne (mais pas toujours)
- Un trajet qui relie les 2 orifices.
Dans 85 à 95% des cas (4-5), la fistule est simple tel que décrite ci dessus. Dans certains cas, la collection diffuse dans l’espace intersphinctérien pour former d’autres trajets plus hauts situés en général, ceux sont les trajets accessoires. On se retrouve ainsi avec une fistule complexe. Le plus souvent ces trajets accessoires sont si courts et borgnes, qu’ils sont appelés diverticules. Leur mise à plat est essentielle, ils doivent donc être détecté lors de la dissection du trajet principal. Mais dans certains cas, les trajets sont plus longs, capable de traverser le sphincter externe, formant un 2è trajet de fistule. Il existe donc plusieurs types de fistules complexes.
La hauteur du trajet transphinctérien de la fistule par rapport à la marge anale détermine le risque d’incontinence anale postopératoire. On différencie donc les fistules basses si le trajet se situe entre la marge anale et la moitié du sphincter, des fistules hautes quand le trajet traverse la moitié supérieure du sphincter externe (figure 2).
Figure 2 : Classification de Arnous
Signes cliniques
Abcès intramural
L’abcès intramural se caractérise par une douleur intense alors que l’examen de la marge anale est normal et que le toucher rectal comme l’anuscopie ne sont pas possibles. Le diagnostique doit être évoqué devant l’intensité de la douleur. La confirmation diagnostique se fait au bloc opératoire.
Abcès marginal
L’abcès marginal est lié à une diffusion de l’infection dans l’espace interspinctérien puis transphinctérien. La douleur est généralement intense, constante, insomniante, et non rythmée par les selles. La fièvre et les signes généraux accompagnent les douleurs dans 19% des cas sur une série rétrospective de 1023 patients (6). L’examen de la marge anale retrouve une zone infiltrée, pulsatile, en phase de collection. On observe parfois un écoulement purulent dans le canal anal ou au niveau de la zone d’abcès. Lorsque cet écoulement apparaît, il soulage le patient. La dysurie, voir la rétention urinaire est un signe de gravité devant faire évoquer une cellulite pelvienne débutante, mais elle peut aussi être secondaire à la douleur. Dans le doute, c’est un signe qui doit faire envisager une chirurgie en urgence.
Fistule anale
La fistule anale est la forme chronique, et l ‘évolution naturelle de l’abcès. Ce trajet qui a permis l’écoulement purulent salvateur de l’abcès, est source d’écoulements chroniques où s’associent pus et passage de selles en raison de la communication qu’elle forme entre le canal anal et la fesse. Parfois la fistule se ferme, la phase d’abcès reprend avec son cortège de douleurs. Dans ces phases, la collection en tension trouve son chemin dans l’espace intersphinctérien exposant au risque de la formation de trajets accessoires. Cliniquement le patient se plaint de périodes douloureuses, dont la clinique est proche de celle de l’abcès décrite plus haute, et de périodes d’accalmies, avec écoulements. Parfois les symptômes sont plus discrets, et se limitent à un prurit, ou un inconfort.
L’examen proctologique
Il s’attache à rechercher un orifice externe dont l’aspect est celui d’un granulome, par lequel on peut passer un fin stylet permettant le diagnostic et l’approche de la hauteur de la fistule. L’orifice interne est rarement atteint sans anesthésie générale, cette tentative douloureuse n’est d’ailleurs pas souhaitable et serait risquée à ce stade. Mais une instillation d’air par l’orifice externe à l’aide d’une seringue peut aussi permettre de percevoir l’orifice interne au toucher rectal, ce geste n’est pas utile en cas de douleur et sera pratiqué dans ce cas sous AG. Le toucher rectal recherche un trajet induré sous forme d’un petit cordon, l’orifice primaire est souvent ressentit comme un petit granulome ou une dépression de la papille sur la ligne pectinée. L’anuscopie recherche le granulome de l’orifice interne avec parfois un écoulement purulent. Il est habituel de retrouver un orifice externe en regard de l’orifice interne, de même on considère souvent que plus l’orifice externe est loin de la marge anale, plus la fistule risque d’être haute (7). Ces situations, bien que fréquentes ne sont pas systématiques et même en cas de fistule d’origine cryptogénique aucune situation n’est univoque.
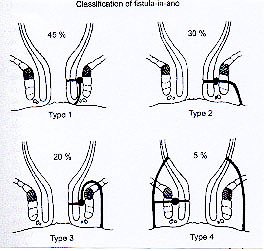
Classification des fistules anales
Figure 1 : classification de Parks.
Type 1 : fistule intersphinctérienne.
Type 2 : fistule transphintérienne.
Type 3 : fistule suprasphinctérienne.
Type 4 : fistule extrasphinctérienne.
Colon et rectum. Vol 1. Mai 2007
Figure 3 : Fistule en fer à cheval
Site proktos.com
La classification la plus fréquemment utilisée est celle de Parks (figure 1) qui distingue 4 types de trajets (8). En France, nous utilisons surtout la classification simplifiée d’Arnous et al (figure 2) qui considère essentiellement la hauteur du trajet transphinctérien de la fistule par rapport à la marge anale (9). Basée sur cette classification, l’étude de Bellan portant sur 6500 patients souffrant de suppuration anale ou périanale (10) a montré la répartition étiologique suivante : 57% de fistules basses, 13% d’abcès intramural, 17,5% de fistules trans-sphinctériennes , et 5% de fistules suprasphinctériennes, les autres infections étant extra-anales.
La classification considère le trajet principal de la fistule mais des trajets accessoires peuvent se former à l’opposé du trajet, c’est la fistule en fer à cheval . Cette fistule complexe se compose d’un trajet principal , le plus souvent postérieur avec un orifice primaire à 6H, un orifice externe sur la fesse et un trajet qui part de l’orifice externe dans une direction transversale vers la fesse opposée, ce trajet est en général borgne (figure 3). La fistule en Y comprend un orifice primaire et 2 trajets aboutissant à 2 orifices externes. Mais le trajet accessoire peut prendre des directions différentes ou être très court, sous forme d’un simple diverticule. Leur repérage est important car s’ils restent en place, la suppuration persiste.
Pour simplifier, nous différencierons pour la suite les fistules basses qui concernent moins de la moitié du sphincter anal, des fistules hautes quand elles se situent sur la moitié haute du sphincter.
Apport des examens complémentaires
Si le diagnostic de la fistule anale reste clinique, avec un taux de repérage de 93% de l’orifice interne par le toucher rectal si l’opérateur est entrainé (11), c’est le plus souvent l’examen proctologique sous anesthésie générale qui permettra un diagnostic topologique précis, et c’est lors de la dissection du trajet principal que les trajets accessoires seront repérés (12). L’intérêt des examens complémentaires est de préciser le trajet principal, les collections et trajets accessoires. Les lésions sphinctériennes préexistantes doivent aussi être recherchées, elles représentent un facteur de risque d’incontinence anale qui pourrait faire discuter la fistulectomie après le drainage. Ces examens sont donc souhaitable si disponibles en urgence car ils ne doivent pas faire retarder la prise en charge chirurgicale.
Les 2 examens utiles sont l’echographie endoanale et l’IRM du canal anal et du pelvis. Les prélèvements bactériologiques sont proposés en cas de fistule atypique afin d’éliminer une origine infectieuse spécifique (tuberculose, actinomycose ou gonococcie …).
L’echographie endoanale
Elle est idéalement réalisée avec une sonde rigide, rotative, mais peut aussi être réalisée avec des sondes linéaires ou souples en fonction de l’équipement de chaque centre. L’instillation d’eau oxygénée par l’orifice externe améliore le contraste et donc le repérage du trajet (13). L’orifice interne apparaît comme une zone hétérogène de la couche hyperechogène (la muqueuse) atteignant parfois le sphincter interne hypoéchogène (14). Le trajet fistuleux prend un aspect hypoéchogène mal limité contenant parfois des bulles d’air, traversant le sphincter externe ou diffusant dans l’espace intersphinctérien. En période aigue, l’inflammation donne un aspect plus épais au trajet. Le trajet dans son parcours extrasphinctérien est plus difficile à repérer car loin du champs d’exploration. La concordance entre l’échographie endoanale et les constations peropératoires sont bonnes pour ce qui est de la hauteur du trajet (91 à 95%), mais moins bonne pour ce qui est de la détection de l’orifice interne (15). Les collections prennent une forme hypoéchogène quand le contenu est purulent et inflammatoire mais dans les formes chroniques de suppurations, le contenu peut devenir granulomateux, nécrotique et prendre un aspect limité et hétérogène en échographie. Ces remaniements sont parfois difficile à différencier des cicatrices postopératoires si le patient a déjà été opéré. L’autre limite de l’échographie est l’exploration des collections à distance du canal anal. En revanche c’est un excellent examen pour la recherche de rupture sphinctérienne, sa sensibilité et sa spécificité étant dans ce cas proche de 100% (16). La douleur en phase aigue limite parfois la possibilité de réaliser cet examen.
L’IRM
Les séquences pondérées en T2 marquent les liquides en hypersignal et les muscles en hyposignal. Les coupes en FatSat (saturation en graisses) effacent la graisse périanale et révèlent ainsi les trajets fistuleux qui sont en hypersignal. Les séquences T1 après injection de gadolinium rehaussent le sphincter interne, les trajets fistuleux sont en hyposignal et les collections abcédées sont en hyposignal. L’instillation de sérum physiologique dans les trajets fistuleux permet de mieux les visualiser. Au total, la concordance entre l’IRM et la chirurgie varie entre 64 et 96% en fonction des études (15).
L’IRM est très utile pour l’exploration des organes de voisinage. Elle détecte aussi les ruptures sphinctériennes sous forme d’une cicatrice fibreuse en hyposignal (17).
En pratique, ces examens ne sont pas obligatoires avant une chirurgie de fistule anale, l’examen sous anesthésie générale étant tout à fait efficient. Ils ne doivent donc pas retarder la chirurgie. Ces examens complémentaires sont nécessaire dans les situations suivantes : patients multiopérés, retard de cicatrisation, écoulement persistant en postopératoire, douleurs inexpliquées, risque de trouble de la continence en post opératoire (suspicion de rupture sphinctérienne préexistante). Le choix entre les 2 techniques est rendu difficile car les études (18-24) sont très hétérogènes en fonction que l’auteur soit gastroentérologue ou radiologue (Tableau 1). L’un des 2 examens complémentaires est suffisant, le choix dépendant de l’accessibilité.
| Auteur | Lunniss PJ (18) | Hussain SM (19) | Maier AG (20) | Gustafsson UM(21) | West RL (22) | Buchanam GN (23) | West RL (24) |
|---|---|---|---|---|---|---|---|
| Année | 1994 | 1996 | 2001 | 2001 | 2003 | 2004 | 2005 |
| Nbrs Patients | 20 | 28 | 39 | 23 | 21 | 104 | 40 |
| Crohn (%) | 25 | 0 | 44 | 4 | 0 | 9 | 0 |
| Sonde EE | Rotative | Rotative | Rotative | Rotative | Rotative | Rotative | Rotative |
| Antenne d’IRM | Externe | Endoanale | Externe | Externe | Endoanale | Externe | Endoanale |
| Orifice primaire | IRM=EE | IRM>EE | Non evalué | EE>IRM | IRM=EE | IRM>EE | IRM=EE |
| Trajet fistule | IRM=EE | IRM>EE | IRM>EE | IRM=EE | IRM=EE | IRM>EE | IRM=EE |
| collections | IRM>EE | IRM=EE | Non évalué | IRM=EE | Non évalué | IRM>EE | IRM=EE |
Tableau 1 : Etudes comparatives echoendoanale versus IRM pour l’évaluation des fistules anales.
Principes du traitement de la fistule anale : l’aspect conventionnel
Le traitement de la fistule anale est toujours chirurgical, il n’y a aucune place pour le traitement médical, si ce n’est l’antibiothérapie sur des terrains à risque de cellulite pelvienne : immunodéprimé, diabétique… Dans ce cas on privilégie les antibiotiques actifs sur les anaérobies et bacilles gram -. En phase aigue d’abcès, l’incision sous anesthésie locale permet de soulager immédiatement le patient mais l’intervention chirurgicale doit être envisagée dans la foulée. La méta analyse de Quah et al (25) a montré que la détection puis mise à plat de la fistule en phase d’abcès réduit de 83% les récidives par rapport à un drainage simple de l’abcès.
Si le traitement de la fistule anale reste chirurgical, une fois drainée et asséchée, l’enjeu devient celui de préserver la continence anale tout en limitant le risque de récidive. Réduire le risque d’incontinence anale revient à préserver la morphologie du sphincter.
Le traitement classique est efficace dans presque 100% des cas dans les équipes spécialisées. Il se déroule en plusieurs étapes :
- Repérage per opératoire du trajet fistuleux qui est constitué :
- d’un orifice interne sur la ligne pectinée au niveau d’une glande d’Hermann et Desfosses située dans la crypte ;
- d’un orifice externe, au niveau extracanalaire, visible le plus souvent sur la fesse ;
- d’un trajet qui relie les 2 orifices.
Ce premier temps opératoire doit s’attacher à ne pas créer de faux trajet, à disséquer le trajet fistuleux depuis l’orifice externe jusqu’au niveau du sphincter strié, en s’aidant d’une instillation d’indigo carmin (le bleu de méthylène n’étant plus disponible) par l’orifice externe. La dissection fine de ce trajet permet de repérer et mettre à plat les cavités abcédées secondaires. Le trajet transphinctérien s’il est bas est ensuite coupé, c’est la fistulotomie mais si ce trajet est trop haut, il faut mettre en place un séton (sorte d’élastique dans le trajet).
- Une fois la cicatrisation du premier temps opératoire terminé (plusieurs semaines, et fonction de la cavité d’abcès mise à plat), le traitement classique consiste à abaisser le séton en coupant le sphincter de haut en bas le plus souvent en un seul geste opératoire mais dans de rares situations, plusieurs séances peuvent être nécessaires. La cicatrisation de la plaie entre chaque séance va ainsi abaisser le trajet en constituant une fibrose au dessus du séton qui maintient les fibres sphinctériennes circulaires. Le trajet est progressivement abaissé pour se transformer en fistule basse que l’on pourra mettre à plat en fin de traitement.
Ce traitement utilisé depuis la célèbre fistule de Louis XIV a largement fait ses preuves mais constitue un fort facteur de risque d’incontinence anale : la fistulotomie n’est autre qu’une sphinctérotomie qui emporte le sphincter externe et le sphincter interne. La hauteur du sphincter coupé est celle de la fistule mais sa largeur (exprimée en degré sur les echoendoscopies) dépend de la rétraction des fibres musculaires au moment de la section, elles se comportent comme un élastique que l’on coupe. S’ajoute la nécrose secondaire à l’abcédation dont l’étendue dépend de la durée d’évolution de la fistule (les poussées d’abcès générant à chaque fois un peu plus de nécrose) et de l’importance de la cavité abcédée au niveau du sphincter. Plus le traitement chirurgical est précoce, plus on préserve la continence anale.
La méthode qui consiste à serrer le séton progressivement en consultation au lieu de faire un abaissement chirurgical au bistouri électrique est source de douleurs et n’a pas montré sa supériorité sur la continence anale (26), cette technique est donc progressivement abandonnée. Elle présente en plus l’inconvénient de ne pas permettre la détection des diverticules éventuels, source de récidive lorsqu’ils ne sont pas mis à plat.
Les cas particuliers
L’abcès intersphinctérien est mis à plat en partant de l’orifice interne qui est disséqué sur une courte distance c’est à dire jusqu’à l’espace intersphinctérien, à l’aide d’un bistouri électrique en coagulation forte : ouverture de la muqueuse, la sous muqueuse, la couche circulaire puis la couche longitudinale du rectum. Il faut s’attacher à ne pas laisser de résidu au sommet de l’abcès.
La fistule en fer à cheval se traite par un drainage double du trajet principal, et du trajet transversal par 2 sétons. Dans un 2è temps, le trajet transversal est mis à plat. Le trajet principal sera mis à plat dans un 3è temps. Si ce trajet principal est haut situé, on pourra proposer des techniques d’épargne sphinctérienne (voir ci dessous). Certaines équipes traitent ces fistules en 2 temps, un premier temps de drainage par séton du trajet principal, le trajet secondaire étant simplement cureté. Puis le trajet principal est abaissé comme une fistule transphinctérienne haute.
Résultats pour la fistulotomie
Si l’opérateur est entrainé, les techniques de fistulotomie en un temps pour les fistules basses ou en plusieurs temps pour les fistules hautes, donnent de bons résultats avec des taux de récidive de 0 à 12% dans les séries prospectives (27, 28 et 29). La principale complication est l’incontinence anale (30).
Le risque d’incontinence anale après fistulotomie a été évalué de manière prospective par la SNFCP et le CREGG grâce à la collaboration du GREP (groupe de recherche en proctologie) et de la commission proctologie du CREGG, sur 224 malades souffrant de fistule anale transphinctérienne cryptogénique. Dans cette étude, menée par le Dr L.Abramowitz, les gastroentérologues spécialisés en proctologie chirurgicale ont montré que le traitement conventionnel décrit ci dessus n’induit pas d’incontinence anale de novo pour les fistules transphinctériennes basses mais fait augmenter le Wexner (score d’incontinence anale allant de 0 à 20 ) de 1 à 4 à un an post opératoire pour les fistules transphinctériennes hautes. D’autres études confirment cette impression, mais les études internationales sont très hétérogènes car si en France, la fistulotomie est réalisée consensuellement de haut en bas en plusieurs temps opératoires (c’est le cas de l’étude CREGG/SNFCP), il existe d’autres types de fistulotomie :
- de bas en haut apportant un taux d’incontinence de 65% (31) ;
- en un seul temps après le drainage apportant un taux d’incontinence anale proche de la fistulotomie en un temps, de 50% (32) ;
- si on considère les études plus homogènes comme celle de Léopold Bellan qui utilise la technique en plusieurs temps opératoires, avec section du sphincter de haut en bas, on retrouve 5 à 11% d’incontinence aux gaz, 5 à 6% d’incontinence aux selles liquides, et aucun cas d’incontinence aux selles solides (33).
Les techniques d’épargne sphinctérienne vont donc devenir une véritable alternative à la fistulotomie en cas de fistule transphinctérienne haute, au prix d’une augmentation du risque de récidive.
Les traitements d’épargne sphinctérienne
L’idée de « boucher » ce trajet plutôt que de le mettre à plat devient une idée séduisante. Tous les traitements décris ci dessous, sont réalisés après un premier temps de drainage par séton, et sur une fistule sèche (pas de collection persistante en IRM ou echoendoscopie )
Le lambeau d’avancement
Vient ensuite l’idée d’une fermeture efficace de l’orifice interne par un lambeau rectal fait de muqueuse et de musculeuse, laissant la fistule se drainer par l’orifice externe, c’est le lambeau d’avancement qui va donner environ 50% de bons résultats : de 37% (34) à 79% (35). Lorsque la muqueuse rectale est saine, c’est sans doute un bon moyen d’éviter la fistulotomie. Les écarts de résultats proviennent d’une hétérogénéité des populations étudiées avec une répartition variable de patients souffrant de MICI et de ceux souffrant de fistule cryptogénique. Le lambeau d’avancement est aussi un geste technique difficile, il faut à la fois apporter une épaisseur suffisante de muqueuse et musculeuse, mais si le lambeau est trop épais, l’abaissement est insuffisant et exerce une traction source d’échec. Un lambeau trop fin se décroche. Les résultats sont donc variables en fonction de l’expertise de l’opérateur. La déception provient d’une hypocontinence retrouvée dans 8 à 35% des cas (36, 37 et 38), l’étude d’Uribe (38) montre même une baisse des pressions de repos et de la contraction volontaire en manométrie anorectale. Ces anomalies sont rapportées à l’utilisation des écarteurs de Parks (39) ou aux lésions sphinctériennes, le sphincter interne pouvant être lésé lors de la fixation du lambeau.
Les colles biologiques
Pour augmenter les chances de fermeture du trajet, les colles biologiques deviennent un moyen intéressant même si leur diffusion est malheureusement limitée par la non prise en charge du produit par la CNAM. Le principe est de combler la fistule avec un mélange de fibrinogène, de facteur XIII de la coagulation, de la thrombine et du calcium. Le fibrinogène se transforme alors en fibrine qui va être colonisé en 2 semaines environ par les fibroblastes. On obtient ainsi une fibrose du trajet. 2 types de colle existent sur le marché : Bériplast et Tissucol. La technique est simple mais requiert une certaine rigueur :
- pas de produit iodé donc pas de champs bétadiné ;
- faire saigner la fistule avant l’application qui se fait à l’aide d’un cathéter double canaux depuis l’orifice interne vers l’orifice externe ;
- bien préparer les 2 solutions qui doivent être fluides. L’utilisation d’un mélangeur magnétique qui réchauffe la colle est un atout ;
- respecter les bonnes indications : trajet long et fin d’une fistule parfaitement drainée et sèche (au moins 2 à 3 mois après la pose du séton) ;
- et couper l’excès de colle au niveau des 2 orifices ;
- un repos strict de 12 à 24h et pas de sport pendant 3 mois.
La fermeture des orifices ne semble pas améliorer le taux de fermeture (40). Le résultat de la colle biologique est d’environ 50% d’après la série d’Adams (41) mais pour ceux qui ont bien répondu, soit 22 patients sur 33, un seul a récidivé sa fistule à 6 mois. On considère comme guéris les patients chez qui le trajet est fermé à 3 mois de l’encollage. Le plus intéressant est que Swinscore et coll (42) montrent une absence d’incontinence anale chez ces patients traités par colle biologique. En revanche, ce résultat est au prix d’un taux élevé de récidive : 50% dans l’étude de Lindsey (43). On connaît moins bien l’évolution à long terme de ces colles biologiques. Haim et coll (44) dans une étude multicentrique considèrent que 26% des patients ayant eu un succès de colle récidivent à 4,1 ans en moyenne. Mais dans cette étude, la récidive se produit dans une région anopérinéale différente, c’est donc probablement une autre fistule qu’une réouverture de la fistule encollée.
Le Plug
Le plug a l’avantage d’être rigide en prenant la forme d’un cône de sous muqueuse de porc lyophilisé. Le principe est le même que la colle biologique, on en fixe la partie interne au niveau de l’orifice pectinéal de la fistule. Sa pose paraît plus aisée mais les résultats ne sont pas meilleurs qu’avec la colle. Son coût important est aussi un frein. Une revue de la littérature de 488 patients (45) retrouve 8,7% d’expulsion du plug, et 54% de fermeture de la fistule. Le plug totalement synthétique de Gore formé de poyglycolide et de trimethylene carbonate, présente un avantage évident pour certains patients qui redoute la présence de proteines de porc mais il ne paraît pas supérieur en terme de faculté à fermer la fistule. Les études sont à chaque fois non randomisées et sur de petites cohortes. Les résultats sont donc très hétérogènes. L’étude de De la Portilla et coll (46) sur 19 patients fait état de 15,8% de fermeture mais seules 3 fistules ont été drainées avant, l’étude de Ratto et al (47), annonce 72,7% de fermeture de fistules drainées au préalable. Toutes ces études sur le plug ont en commun, l’absence de trouble de la continence fécale après traitement de la fistule.
Les techniques d’avenir
D’autres techniques visent à fermer l’orifice interne de la fistule sans toucher au trajet si ce n’est un simple curetage pour éliminer le tissu granulomateux. Tobisch et coll (48) obtiennent 74% de succès en fermant l’orifice interne et en disséquant l’ensemble du trajet de fistule par technique de fistulectomie. Mais le taux d’incontinence anale post procédure était de 56%. Le clip OVESCO apporte de bons résultats pour la fermeture des fistules anastomotiques post chirurgicales. La firme propose de l’utiliser pour la fermeture de fistule anale mais les publications ne permettent pour l’instant pas de conclure avec un seul cas clinique publié et une première expérience sur le cochon (49).
La technique LIFT (Ligation of the intersphincteric fistula tract) a été publiée par Rojanasakul en 2009 (50). Elle consiste à disséquer l’espace intersphinctérien jusqu’au niveau du trajet transphinctérien qui est ligaturé et sectionné. Le trajet externe est cureté puis méché, pendant que l’incision cutanée, point de départ de la dissection intersphinctérienne, est refermée par un point de fils résorbable. La plus grande série publiée est celle de Tan (51), elle rapporte 78% de taux de fermeture, les échecs étant liés à un suintement par le trajet transphinctérien ou la persistance de la fistule externe. Ellis en 2010 (52) améliore le taux de fermeture par la pose d’un plugh dans ce trajet externe.
Conclusion
La fistulectomie en un temps pour les fistules transphinctériennes basses et en 2 temps pour les fistules hautes est le traitement chirurgical de référence, il apporte un taux de guérison proche de 90% dans les équipes spécialisées. Mais ce traitement, pour les fistules hautes, expose à un risque non négligeable d’incontinence anale, proportionnelle à la hauteur de la fistule (5 à 40% dans la littérature anglosaxone). Le recours aux traitements d’épargne sphinctérienne dans cette situation particulière est donc justifié, en acceptant une augmentation du taux de récidive surtout quand il existe des cofacteurs de risque à l’incontinence (traumatisme périnéal préexistant, insuffisance sphinctérienne, femme jeune en âge de procréer …)
Références
- Arnous J, Denis J, Puymonbrun T . Les suppurations anales et périanales. A propos de 6500 cas. Concours Med 1980 . 12 :1715-29.
- Sanio P. Fistula-in-ano in a defined population. Incidence and epidemiological aspects. 1984. Ann Chir Gynaecol 73 :219-24
- Seow-Choen F, Nicholls RJ. Anal Fistula. Br J Surg. 1992. 79 :197-205
- Abcarian H, Dodi G, Girona J, et al. Fistula in ano. Internal J Colorectal Dis. 1987. 2 :51-71.
- Parks AG, Gordon PH, Hardcastle JD. A classification of fistula in ano. Br J Surg. 1976. 63 :1-12.
- Ramanujam PS, Prassad ML, Abcarian H et al. Perianal abcesses and fistulas. A study of 1023 patients. Dis Colon Rectum.1984. 27(9) :593-7.
- Becker A, Koltun L, Sayfan J. Simple clinical examination predicts complexity of perianal fistula. 2006. Colorectal Dis 8(7) :601-4.
- Parks AG, Gordon PH, Hardcastle JD. A classification of fistula-in-ano. Br J Surg . 1976. 63(1) :1-12
- Arnous J, Parnaud E, Denis J. Quleques réflexions sur les abcès et fistules à l’anus. A propos de 3000 intervention. Rev Prat 1972. 22 :1793-814.
- Arnous J, Denis J, Puy-Montbrun T. Les suppurations anales et perianales. A propos de 6500 cas. Concours Med. 1980. 12 :1715-29
- Gonzales-Ruiz C, Kaiser AM, Vukasin P et al. Intraopérative physical diagnosis in the management of anal fistula. 2006. Am Surg 72(1) :11-5.
- Choen S, Burnett S, Bartram CI et al. Comparison between anal endosonography and digital examination is the évaluation of anal fistulae. 1991. Br J Surg 78(4) :445-7.
- Buchanan GH, Bartram CI, Williams AB et al. Value of hydrogen peroxide enhancement of three dimentional endoanal ultrasound in fistula in ano. 2005. Dis Col Rectum 48 :141-7.
- Etienney I, de Parades V, Atienza P. Suppurations anales. 2003. Acta endoscopica 33 :85-92.
- Atienza P, Méary N, de Parades V, et al. Fistules anales. 2002. Editions scientifiques et médicales Elservier SAS, Paris) Gastroenterologie, Encycl Med Chir 9-086-C-10, p14
- Romano G, Rotondano G, Esposito P et al. External anal sphincter defects : corrélation between pre-operative anal endosonography and intraoperative findings. 1996. Br J Radiol 69 :6-9.
- Cuenod CA, de Parades V, Siauve N et al. IRM des suppurations anopérinéales. 2003. J Radiol 84 :516-28.
- Lunniss PJ, Barker PG, Sultan AH et al. Magnetic resonance Imaging of fistula-in-ano. 1994. Dis Colon Rectum 37 :708-18.
- Hussain SM, Stoker J, Shouten WR et al. Fistula in ano : endoanal sonography versus endoanal MR Imaging in classification. 1996. Radiology 200 :475-81.
- Maier AG, Funovics MA, Kreuzer SH et al. Evaluation of perianal sepsis : comparison of anal endosonography and magnetic résonance Imaging. 2001. J Magn Reson Imaging 14 :254-60.
- Gustafsson UM, Kahvecioglu B, Ahlström H et al. Endoanal ultrasound or magnetic résonance Imaging for preopartive assessment of anal fistula :a comparative study. 2001. Colorectal Dis 3 :189-97
- West RL, Zimmerman DDE, Dwarkasing S et al. Prospective comparison of hydrogen peroxide-enhanced three-dimensional endoanal ultrasonography and endoanal magnetic resonance imaging of perianal fistula. 2003. Dis Colon Rectum 46 :1407-15
- Buchanam GN, Halligan S, Bartram CI et al. Clinical examination, endosonography, and MR Imaging in preoperative assessment of fistula in ano :comparison with outcome-based reference standard. Radiology 233 :674-81.
- West RL, Dwarkasing S, Felt-Bersma RJ et al. Hydrogen peroxide-enhanced three-dimensional endoanal ultrasonography and endoanal magnetic résonance Imaging in evaluating perianal fistulas : agreement and patient préférence. Eur J Gastroenterol Hepatol 16 :1319-24
- Quah HM, Tang CL, Eu KW et al. Meta-analysis of randomized clinical trials comparing drainage alone vs primary sphincter-cutting procédures for anorectal abscess-fistula. 2006. Int J Colorectal Dis . 21(6) :602-9
- Garcia-aguilar J, Belmonte C, Wong DW et al. Cutting séton versus two stage seton fistulotomy in the surgical management of High anal fistula. 1998. Br J Surg 85(2) :243-5.
- Fucini C. One stage treatment of anal abscesses and fistulas. A clinical appraisal on the basis of two different classifications. 1991. Int J Colorectal Dis 6(1) :12-6
- Tang Cl, Chew SP, Seow-Choen F. Prospective randomized trial of drainage alone versus drainage and fistulotomy for acute perianal abscesses with proven internal opening. 1996. Dis Colon Rectum 39(12) :1415-7
- Pescatori M, Maria G, Anastasio G et al. Anal manometry improves the outcome of surgery for fistula in ano. Dis Colon Rectum 32(7) :588-92.
- Garcia-Aguilar J, Davey CS et al. Patient satisfaction after surgical treatment for fistula in ano. 2000. Dis Colon Rectum 43(9) :1206-12.
- Van tets WF, Kuijpers JH. Seton treatment of perianal fistula with High anal or rectal opening. 1995. Br J Surg 82(7) :895-7
- Williams JG, MacLeod CA, Rothenberger DA et al. Seton treatment of high anal fistulae. 1991. Br J surg 78(10) :1159-61.
- Denis J, Lemarchand N, Dubois N et al. Les fistules anales suprasphinctériennes. 1983. Ann Gastroenterol Hepatol 19 :399-404
- Van der Hagen SJ, Baeten CG, Soeters PB, Van Gemert WG (2006) Long-term outcome following mucosal advancement flap for High périnéal fistulas and fistulotomy for low perianal fistulas. Reccurent perianal fistulas : failure of treatment or recurrent patient disease ? Int J Colorectal Dis (2006) 21:784-90
- Van Koperen PJ, Wind J, Bemelman WA et al (2008) Long term functional outcome and risk factors for récurrence after surgical treatment for low and High perianal fistulas of cryptoglandular origin. Dis Colon Rectum 51:1475-81
- Zimmerman DD, Delemarre JB, Gosselink MP et al. Smoking affects the outcome of transanal mucosal advancement flap repair of transsphincteric fistulas. 2003. Br J Surg 90(3) :351-4.
- Kreis ME, Jehle EC, Ohlemann M et al. Functional results after transanal rectal advancement flap repair of trans-sphincteric fistula. 1998. Br J Surg : 85(2) :240-2
- Uribe N, Millan M, Minguez M et al. Clinical and manometric results of endorectal advancement flaps for complex anal fistula. 2007. Int J Colorectal Dis 22(3) :259-64
- Van Tets WF, Kuijpers JH, Tran K et al. Influence of Parks anal retractor on anal sphincter pressures. 1997. Dis Colon Rectum 40(9) : 1042-5
- Singer M, Cintron J, Nelson R et al Treatment of fistulas-in-ano with fibrin sealant in combination with intra-adhésive antibiotics and/or surgical closure of the internal fistula opening. 2005. Dis Colon Rectum 49 :1736-40.
- Adams T, Yang J, Kondylis LA, Kondylis PD. Long-term outlook after successful fibrin glue ablation of cryptoglandular transsphincteric fistula-in-ano. 2008. Dis Colon Rectum Oct 51(10):1488-90. Epub 2008 Jul 9.
- Swinscoe MT, Ventakasubramaniam AK, Jayne DG. Fibrin glue for fistula-in-ano : the évidence reviewed. 2005. Tech Coloproctol 9:89-94
- Lindsey I, Smilgin-Humphreys MM, Cunnigham C et al. A randomized, controlled trial of fibrin glue conventional treatment for anal fistula. 2002. Dis Colon Rectum 45(12) :1608-15.
- Haim N, Neufeld D, Ziv Y et coll. Long-term results of fibrin glue treatment for cryptogenic perianal fistulas :a multicenter study. 2011. Dis Colon Rectum. Oct ;54(10) :1279-83.
- O’Riordan JM, Datta I, Johnston C et al. A systematic review of the anal fistula plug for patients with Crohn’s and non Crohn’s related fistula in ano. 2012. Dis Colon Rectum. Mar ;55(3) :351-8
- De Portilla F, Rada R, Jimenez-rodriguez R et al. Evaluation of a new synthetic plug in the treatment of anal fistulas : results of a pilot study. 2011. Dis Colon Rectum Nov ;54(11) :1419-22
- Ratto C, Litta F, Parello A et al. Gore Bio-A fistula plug : a new sphincter-sparing procedure for complex anal fistula. 2012. Colorectal Dis. May ;14(5) :e264-9
- Tobisch A, Stelzner S, Hellmich G et al. Total fistulectomy with simple closure of the internal opening in management of complex cryptoglandular fistulas : long-term results and functional outcome. 2012. Dis Colon Rectum Jul ;55(7) :750-5
- Prosst RL, Herold A, Joos AK et al. The anal fistula claw :the OTSC-clip for anal fistula closure. 2011. Colorectal Dis. Nov 28
- Rojanasakul A. LIFT procedure : a simplified technique for fistula-in-ano. 2009. Tech coloproctol 13 :237-40.
- Tan KK, Tan IJ, Lim FS et al. The anatomy of failures following the ligation of intersphincteric tract technique for anal fistula : a review of 93 patients over 4 years. 2011. Dis Colon Rectum 54 :1368-72.
- Ellis CN. Outcomes with the use of bioprosthetic grafts to reinforce the ligation of the intersphincteric fistula tract for the management of complex anal fistulas. 2010. Dis Colon Rectum 53 :1361-4.
Les 5 points forts
- La fistule anale cryptogénique est une infection de la glande d’Hermann et Desfosses, située sur la ligne pectinée, (orifice interne) diffusant dans l’espace intersphinctérien, traversant le sphincter externe pour former une collection (abcès) au niveau de la fesse qui s’extériorise à la peau (l’orifice externe).
- Le traitement de la fistule anale cryptogénique est toujours chirurgical
- L’IRM et l’échographie endoanale peuvent être utiles au diagnostic topographique des collections, trajets et ruptures sphinctériennes préexistantes éventuelles mais elles ne doivent pas retarder la prise en charge chirurgicale.
- La fistulectomie en un temps est le traitement de référence de la fistule anale basse (moins de 50% de la hauteur sphinctérienne concernée).
- Le traitement de la fistule anale transphinctérienne haute comporte dans un premier temps un drainage par séton du trajet. Les traitements d’épargne sphinctérienne préservent la continence fécale, au prix d’un sur-risque de récidive.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION