Cancer du colon : classifications moléculaires et anatomiques nécessaires à la décision thérapeutique
POST’U 2018
Cancérologie
Objectifs pédagogiques
- Connaître les nouvelles classifications anatomiques et moléculaires
- Connaître l’impact pronostique de cette classification
- Savoir utiliser les classifications pour le choix des thérapies ciblées
- Quelle thérapie ciblée pour quel cancer ?
Testez-vous
Nous vous invitons à tester vos connaissances sur l’ensemble des QCU tirés des exposés des différents POST'U. Les textes, diaporamas ainsi que les réponses aux QCM seront mis en ligne à l’issue des prochaines journées JFHOD.
Testez vos connaissances sur le sujet.
Les 5 points forts
- La localisation colique droite du CCR représente 35 % des cas et est associée à un mauvais pronostic, qu’il s’agisse d’une maladie métastatique ou non.
- Les différences biologiques intrinsèques à la tumeur sont de nature à expliquer, au moins en partie, les variations pronostiques de la localisation tumorale.
- Des données récentes issues d’essais de phase III suggèrent un effet prédictif de la localisation tumorale (droite vs gauche) sur l’efficacité des biothérapies antiEGFRs (cetuximab et panitumumab) et antiVEGF (bevacizumab).
- La classification CMS distingue 4 sous-types moléculaires dans 80 % des CCRM. Elle a une valeur pronostique et probablement en partie prédictive d’efficacité des biothérapies. Elle est relativement corrélée à la localisation tumorale gauche ou droite de la tumeur primitive.
-
Les déterminations à rechercher systématiquement dès le début de la prise en charge d’un CCRM sont :
- le statut MSI (en immuno-histochimie) pour la sélection des patients candidats à une immunothérapie ;
- la présence d’une mutation de l’oncogène RAS prédictive de non efficacité des antiEGFRs ;
- la présence d’une mutation de l’oncogène BRAF qui confère à la tumeur un très mauvais pronostic et nécessite une intensification de la chimiothérapie.
Liens d’intérêt
Roche, Merck, Bayer, Sanofi, Amgen, Servier, Novartis
Mots-clés : CCR, biologie moléculaire, pronostique, prédictif
Introduction
Il n’est pas si loin le temps où le cancer colorectal (CCR) ne faisait qu’une seule entité. Le diagnostic de CCR imposait alors dans le meilleur des cas une résection de la tumeur primitive avec une chimiothérapie adjuvante (5FU ou folfox) en cas d’extension ganglionnaire et une chimiothérapie palliative en cas de maladie métastatique (5FU, folfox ou folfiri). Le type de chimiothérapie n’était déterminé que par le diagnostic histologique d’adénocarcinome du côlon sans influence ni de la biologie ni de la topographie de la tumeur primitive.
Les progrès thérapeutiques et l’affinement diagnostique permis par la biologie moléculaire rendent aujourd’hui le choix thérapeutique beaucoup plus complexe. En effet, de nombreux facteurs biologiques pronostiques et/ou prédictifs d’efficacité (ou d’inefficacité) des traitements permettent un choix thérapeutique « à la carte » avec en corollaire une amélioration de la survie des patients. En outre, ce « guidage moléculaire » permet d’éviter de délivrer des traitements toxiques, onéreux sans chance d’efficacité.
La classification anatomique
Les différences épidémiologiques entre côlon droit et côlon gauche
Les données épidémiologiques nous ont montré depuis longtemps que l’évolution de l’incidence du cancer colorectal variait en fonction de la localisation tumorale (Fig. 1). Ainsi, on note une augmentation de l’incidence du côlon droit et du côlon gauche plus rapide chez l’homme (+ 11,7 % et 10,3 % par période de 5 ans) que chez la femme (+ 5,9 % et 6,1 %) et une stabilité globale des cancers du sigmoïde et du rectum [1]. Les hypothèses avancées suggèrent que les aliments et nutriments agissent de manière spécifique et variable suivant la localisation colique. Ainsi, les fibres qui sont dégradées dans côlon entraînent une acidification du milieu et une inhibition des enzymes de transformation des acides biliaires primaires en secondaires. Cette action s’exerce principalement sur le côlon droit. L’action anti-oxydante des vitamines A, C et E agit principalement sur la muqueuse du côlon transverse et du côlon gauche. Le calcium, en se fixant aux sels biliaires, les transforme en savons insolubles avec une action pro-inflammatoire sur le côlon droit principalement. Ces éléments expliquent au moins en partie les variations géographiques d’incidence, le gradient nord-sud du CCR. En outre, les études de populations migrantes suggèrent que les taux d’incidence de CCR de ces populations rejoignent ceux du pays d’accueil en une seule génération.
Figure 1. Évolution incidence standardisée du CCR en France chez l’homme – D’après Chauvennet M et al.
Le développement de l’intestin
L’embryologie de l’intestin explique les limites anatomiques et les différences potentielles entre le côlon droit (intestin moyen) et le côlon gauche (intestin postérieur). À 5 semaines de développement, l’intestin moyen communique avec le sac vitellin. Il débute à l’abouchement de la voie biliaire dans le duodénum et se termine à la limite des 2/3 droit – 1/3 gauche du côlon transverse. Cette anse intestinale primaire subit une rotation anti-horaire de 270° autour de l’axe mésentérique supérieur pour constituer le « côlon droit » vascularisé par l’artère mésentérique supérieure. L’intestin postérieur (ou inférieur) poursuit l’intestin moyen jusqu’au rectum et est vascularisé par l’artère mésentérique inférieure [2].
Impact pronostique de la localisation tumorale
La localisation colique droite du CCR représente 35 % des cas et est associée à un mauvais pronostic, qu’il s’agisse d’une maladie métastatique ou non. Les données du registre américain (SEER) ont en effet montré sur plus de 90 000 cancers coliques de stade III (2000-2012) une surmortalité pour les cancers du côlon droit par rapport au côlon gauche (HR : 1,35 [1,32-1,38]). Les tendances étaient similaires sur plus de 64000 CCR (2000-2012) de stade IV avec une survie significativement abaissée pour les cancers du côlon droit (HR : 1,32 [1,30-1,35]) [3].
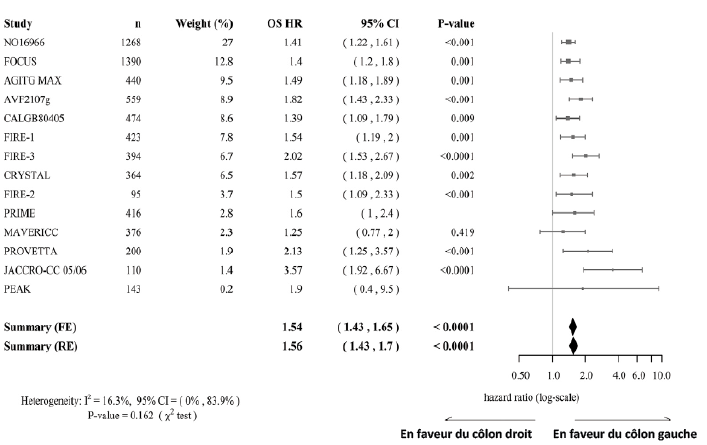
Les résultats d’une méta-analyse de 13 essais randomisés et d’une étude prospective confirment le caractère prédictif de la localisation tumorale (Tableau I). Parmi les 6 652 patients avec un CCR métastatique traités en 1re ligne, la Survie Globale (SG) et la Survie Sans Progression (SSP) était plus faible pour les cancers du côlon droit (respectivement HR : 1,56 [1,43-1,70] et HR : 1,33 [1,2-1,48]) indépendamment du traitement reçu [4].
Tableau I. Impact pronostique de la localisation tumorale (côlon gauche vs côlon droit. Méta-analyse de 13 essais randomisés et d’une étude prospective de 1re ligne) – D’après Holch JW et al.
Les différences biologiques intrinsèques à la tumeur sont de nature à expliquer au moins en partie les variations pronostiques de la localisation tumorale [5, 6].
Impact prédictif de la localisation tumorale
L’effet prédictif d’efficacité de la chimiothérapie cytotoxique de la localisation tumoral n’a jamais été mis en évidence. À l’inverse des données récentes issues d’essais de phase III suggèrent un effet prédictif de la localisation tumorale (droite vs gauche) sur l’efficacité des biothérapies antiEGFRs (cetuximab et panitumumab) et antiVEGF (bevacizumab).
L’essai américain CALGB 80405 qui comparait une biCT de type folfox ou folfiri associée au cetuximab ou au bevacizumab n’a pas montré de différence de SG ni de SSP entre ces deux associations. L’analyse de sous-groupe a révélé un bénéfice en SG et SSP en faveur du bras cetuximab uniquement dans les cancers du côlon gauche (Respectivement HRSG : 0,82 [0,69-0,96] et HRSSP : 0,84 [0,72-0,98]) (Tableau II). À l’inverse il existait un bénéfice (à la limite de la significativité pour la SG probablement du fait de l’effectif limité) en faveur du bevacizumab pour les cancers du côlon droit (HRSG : 1,26 [0,98-1,63] et HRSSP : 1,26 [1,0-1,62] [7]. Les données concernant les taux de réponses tumorales étaient moins claires pour les cancers du côlon droit avec une tendance en faveur des antiEGFRs.
Tableau II. Impact de la localisation tumorale sur l’efficacité du cetuximab et du bevacizumab (SSP et SG) à partir des données de l’essai CALGB 80405
Ces résultats ont été reproduits dans l’essai allemand FIRE-3 qui comparait le folfiri associé au cetuximab ou au bevacizumab [8].
L’analyse poolée des essais PRIME (folfox +/– panitumumab) et CRYSTAL (folfiri +/– cetuximab) en première ligne du CCRM RAS WT objectivait un bénéfice significatif de l’ajout d’un antiEGFR, en réponse, SSP et SG uniquement pour les cancers du côlon gauche. La SG était améliorée par l’antiEGFR pour les cancers coliques gauches avec un HR à 0,69 [0,58-0,83]). Il n’y avait à l’inverse aucune différence en SSP et SG pour les cancers du côlon droit [4].
Au total, les caractéristiques biologiques différentes des cancers du côlon droit et du côlon gauche pourraient expliquer, par le biais d’une carcinogénèse différente non seulement l’impact pronostique mais peut-être également l’impact prédictif de la localisation tumorale sur l’efficacité des biothérapies (anticorps antiEGFR et antiVEGF).
Classifications moléculaires
Biologie moléculaire du côlon droit et du côlon gauche
Les altérations génétiques ou chromosomiques du CCR permettent de distinguer 2 grandes familles [9, 10] :
- Les tumeurs avec instabilité génétique représentant 15 % des CCR. Il s’agit de tumeurs présentant une instabilité des microsatellites (MSI) c’est-à-dire porteuses de mutations sur les gènes du système MMR (MisMatch Repair) impliqués dans la réparation des erreurs de réplication de l’ADN (réparation du mésappariement de l’ADN). Tous les cancers développés dans le cadre d’une prédisposition familiale de type Lynch appartiennent à ce groupe et représentant 30 % de l’ensemble des tumeurs MSI. Le phénotype MSI confère un excellent pronostic si bien que très peu d’entre elles vont évoluer vers le stade métastatique (5 % de tumeur MSI seulement sur l’ensemble des CCRM). Il est dans ce cadre admis qu’il n’est pas utile de traiter par chimiothérapie adjuvante un CCR de stade II à haut risque (peu différencié, occlus ou perforé, emboles lymphatiques, moins de 8 ganglions examinés) lorsqu’il présente un phénotype MSI.
Ces tumeurs se développent principalement dans le côlon droit et chez la femme. Elles sont associées à un profil biologique faisant intervenir des mutations diverses tout au long de la carcinogénèse : hyperméthylation du promoteur de MLH1 (formes sporadiques), mutations de BAX, de la ßcaténine, de TGFß et de BRAF.
Enfin, on trouve dans ce groupe avec instabilité génétique plus souvent des tumeurs CIMP+ (CpG Island Methylator Phenotype) caractérisées par des séquences nucléotidiques de la région promotrice de gènes présentant une répétition du motif Cytosine-Guanine (CpG). La méthylation des cytosines de ces séquences est responsable d’un défaut d’expression des gènes correspondants. Elles représentent environ 20 % de l’ensemble des CCR et près de 2/3 des tumeurs MSI. Elles sont dans ce cadre plus souvent associées à une mutation de BRAF. - Les tumeurs avec instabilité chromosomique (CIN+) qui représentent 85 % des CCR. Elles sont caractérisées par une perte d’un morceau de chromosome (Loss Of Heterozygosity) : il s’agit principalement d’un fragment du bras long du chromosome 5 (LOH 5q) mais aussi des chromosomes 2p, 17p, 18q. On y trouve les mutations et perte d’APC, la plupart des mutations RAS, de P53 et peu de mutations BRAF. Elles se développent préférentiellement dans le côlon gauche et chez l’homme.
La classification moléculaire CMS (Consensus Molecular Système)
Les cancers du côlon apparaissent donc comme un groupe de maladies très hétérogène. Un consortium international d’experts a récemment permis de dégager, à partir de 6 classifications moléculaires et plus de 4 000 patients, 4 sous-types de cancers colorectaux. Il s’agit de la classification CMS en 4 groupes caractérisés par des facteurs moléculaires, biologiques et cliniques [11]. Il faut noter que 21 % des CCR n’appartiennent à aucun de ces 4 groupes (Tableau III).
Tableau III. Classification CMS et corrélation phénotypique – D’après Guinney J et al.
Groupe CMS-1 (MSI, Immune) : Représente 13 % des CCR et caractérisés par des tumeurs avec instabilité des microsatellites (MSI high), par une infiltration immune marquée, souvent CIMP élevé (CIMP high = phénotype méthylateur) et par des tumeurs mutées BRAF. La localisation est préférentiellement à droite. Leur pronostic est bon en l’absence de métastase et mauvais en cas d’évolution métastatique (survie après rechute faible).
Groupe CMS-2 (Canonical) : Représente 35 % des CCR localisés plutôt à gauche sans instabilité des microsatellites (MSS), marqués par des mutations somatiques fréquentes (SCNA high) avec une surexpression de l’EGFR et activation de la voie WNT/MYC fréquentes. Leur pronostic est intermédiaire.
Groupe CMS-3 (Metabolic) : Représente 11 % des CCR, de type épithélial, MSS dans 90 % des cas, et caractérisés par des mutations RAS fréquentes et peu de mutations somatiques. Elles sont réparties de manière assez homogène entre le côlon gauche et le côlon droit. Leur pronostic est intermédiaire.
Groupe CMS-4 (Mesenchymal) : Représente 20 % des CCR. Elles sont caractérisées par de nombreuses altérations somatiques (SCNA high), une activation fréquente du TGFß et de l’angiogenèse, des tumeurs plus souvent MSI et se situent préférentiellement sur le côlon gauche. Leur pronostic est mauvais en situation métastatique.
Impact pronostique et prédictif de la biologie moléculaire du CCR
Valeur pronostique ou prédictive propre des mutations ou altérations génétiques utilisés :
Dans la pratique clinique
Le statut MSI (MSI-Hight : 15 % des CCR) confère un bon pronostic aux CCR non métastatiques. Les récidives et l’évolution métastatique sont rares. Seulement 5 % des CCRM présentent une instabilité des microsatellites. Les tumeurs MSI sont par ailleurs résistantes au 5FU en adjuvant [12]. Pour cette raison les tumeurs de stade II MSI réséquées ne doivent pas faire l’objet d’une chimiothérapie adjuvante y compris lorsqu’il existe des facteurs de mauvais pronostic. La survie après rechute est à l’inverse mauvaise. Les tumeurs MSI sont caractérisées par une forte infiltration immunitaire témoignant de leur caractère hypermuté. Elles sont ainsi d’excellentes candidates à l’immunothérapie (activation lymphocytaire par les antiPD1 ou antiPD-L1) qui a montré dans des essais de phase II des taux de réponse élevés et des survies prolongées dans près de 80 % des cas, chez des patients métastatiques lourdement prétraités [13]
Les mutations RAS (RAS M) (50 % des CCR) apparaissent prédictives de non efficacité des antiEGFRs. Ainsi l’utilisation du cetuximab ou du panitumumab en situation métastatique n’est pas utile, quelle que soit la ligne de traitement, lorsque la tumeur présente une mutation de RAS (KRAS exons 2-3 et 4 ou NRAS exons 2-3-4). Le caractère pronostique de la mutation RAS a été discuté, mais ne peut être affirmé.
La mutation BRAF (BRAF M) (5 % des CCR) est mutuellement exclusive de la mutation RAS. Elle est associée à un phénotype MSI dans 50 % des cas et ne se rencontre qu’en cas de tumeur RAS WT où elle représente environ de 10 % des patients. En situation métastatique, elle confère à la tumeur un très mauvais pronostic et n’est pas prédictive d’inefficacité des antiEGFRs [14]. La SG de ces patients est de l’ordre de 10 mois avec une bichimiothérapie (folfox ou folfiri) associé à une biothérapie (antiEGFRs ou bevacizumab). Les données cliniques dans ce sous-groupe de patients ont montré que l’intensification thérapeutique améliorait significativement le pronostic. Ainsi la trichimiothérapie de type folfoxiri associée au bevacizumab a permis d’obtenir des survies de l’ordre de 20 mois comparée à la bichimiothérapie de type folfiri associée au bevacizumab où les survies globales n’étaient que de 10 mois [14]. Elle est devenue l’association recommandée en 1re intention pour ce sous-groupe de patients [16]. Un essai randomisé de trichimiothérapie associé au cetuximab vs trichimiothérapie associée au bevacizumab est en cours et s’adresse exclusivement aux patients BRAFM (FIRE-4.5 ; AIO KRK-0116). En situation non métastatique, il ne semble pas y avoir d’impact pronostique de la mutation BRAF chez les patients avec un CCR MSI (pas de différence de survie entre les patients MSI/BRAF WT et MSI/BRAF M non métastatiques). L’impact pronostique péjoratif de la mutation BRAF est donc dépendant du statut MSI en situation adjuvante [17].
En cours de développement
À l’instar des adénocarcinomes gastriques et des carcinomes mammaires, la surexpression d’HER2 pourrait conférer aux CCR une sensibilité aux inhibiteurs d’HER2. Cette surexpression est présente dans près de 20 % des CCR, principalement localisée à gauche (2/3 des cas) (18). Un essai de phase II (HERACLES) a suggéré que l’association du Trastuzumab (anticorps monoclonal recombinant spécifique des récepteurs HER2/neu) et du Lapatinib (un inhibiteur des domaines intracellulaires de la tyrosine kinase des récepteurs EGFR (ErbB1) et HER2 (ErbB2)) était efficace chez 24 patients lourdement prétraités (5 lignes antérieures) pour un CCRM HER2+ (+++ ou ++ et FISH+). Les taux de réponse étaient de 34,7 % [19]. Un essai de phase III est en cours pour tester ce double blocage HER2 dans le CCRM.
Impact pronostique de la classification CMS
La classification CMS a une valeur pronostique indiscutable.
En cas de CCR non métastatiques le pronostic est favorable pour les tumeurs CMS-1 et dans une moindre mesure CMS-2 [11]). À l’inverse les tumeurs CMS-4 ont un mauvais pronostic.
À l’inverse, en situation métastatique c’est le sous type 1 qui est lié au plus mauvais pronostic (survie après rechute mauvaise). À partir de 313 patients métastatiques inclus dans l’essai FIRE-3, la SG des tumeurs CMS-1 était de 14,8 mois (CMS-1) et de 31,9 mois pour les CMS-2 (20) (Fig. 2).
Figure 2. Impact pronostique de la classification CMS en situation métastatique à partir de 313 patients RAS WT de l’essai FIRE-3. – D’après Stinzing S et al.
Impact prédictif de la classification CMS
L’impact prédictif de la classification CMS a été suggéré par son application aux données exploratoires de l’essai CALGB80405 et FIRE-3 respectivement sur 581 patients et 313 patients RAS WT pour lesquels les données biologiques étaient disponibles (Fig. 3).
Figure 3. Impact prédictif de la classification CMS sur l’efficacité du bevacizumab et du cetuximab à partir des données de FIRE-3 et de CALGB. – D’après Stinzing S et al. et Venook AP et al.
Il en ressort que pour les tumeurs CMS-1, localisées préférentiellement à droite, l’association biCT+bevacizumab pourrait être meilleure en termes de SG et de SSP que l’association biCT + cetuximab (significatif uniquement dans l’essai CALGB80405).
Pour les tumeurs CMS-2 et 4, localisées préférentiellement dans le côlon gauche, il existait un effet favorable du cetuximab en termes de SG (significatif uniquement dans CALGB80405 pour les CMS-2 et dans FIRE-3 pour les CMS-4) par rapport au bevacizumab.
Ces données pourraient donc être de nature à expliquer au moins en partie l’effet prédictif de la localisation tumorale à droite sur l’efficacité du bevacizumab et à gauche sur l’efficacité du cetuximab.
Impact prédictif du microARN miR31-P53
Les Micro-ARN (miR) sont des fragments d’ARN intracytoplasmiques pouvant inhiber la traduction de transcrits (ARNm) et ainsi réguler l’expression de nombreux gènes. À partir de l’analyse rétrospective du profil d’expression de 1 145 miARN issus de l’essai FIRE-3, Laurent-Puig et al. ont identifié le microARN mir31-3p, ayant une valeur prédictive de bénéfice des anti-EGFR [21].
Lorsque le miR31-3p était sous exprimé (2/3 des cancers coliques gauches), l’association biCT+cetuximab apparaissait supérieure en termes de SSP, SG et réponses que l’association biCT-bevacizumab (respectivement HRSSP = 0,82 [0,59 ; 1,13] p = 0,16, HRSG = 0,60 [0,40 ; 0,90] p = 0,005 et ORRR = 3,37 [1,70 ; 6,67] p = 0.0005). À l’inverse pour les tumeurs coliques droites le miR31-3p était surexprimé dans 2/3 des cas et l’effet de la biCT+bevacizumab semblait supérieur (respectivement HRSSP = 1,27 [0,81 ; 2,02] p = 0,24, HRSG = 1,10 [0,65 ; 1,87] p = 0,67) (Fig. 4).
Figure 4. Impact prédictif de l’expression de miR31-3p sur l’efficacité du cetuximab à partir à partir des données de FIRE-3. D’après Laurent-Puig P et al.
Un kit de mesure de l’activité du miR31-3p est en cours de diffusion en Europe et pourrait constituer un test théranostique pour les patients atteints de cancer colorectal, RAS WT justifiant d’une prescription d’un antiEGFR.
Conclusion
La meilleure compréhension de la cancérogenèse colorectale et de la biologie tumorale permet aujourd’hui de définir des profils biologiques spécifiques de CCR ayant une valeur pronostique et parfois prédictive d’efficacité des thérapeutiques. L’utilisation de la classification CMS n’est pas faisable en routine car elle nécessite d’analyser plus de 80 gènes. La localisation tumorale bien que recommandée par l’ESMO et le NCCN (avec des conclusions différentes !) n’apparaît pas aujourd’hui être un élément de premier plan pour le choix thérapeutique. L’ensemble des résultats présentés sont en effet issus d’études de sous-groupes non pré-spécifiées avec une significativité absente ou souvent modérée. Des données plus larges, prospectives sont donc nécessaires afin de mieux comprendre les implications biologiques sous-jacentes avant qu’elle puisse être considérée comme un critère exclusif de choix de la thérapeutique ciblée dans le CCRM.
À l’inverse les connaissances biologiques actuelles et leurs implications thérapeutiques permettent de recommander la détermination :
-
Du statut MSI (IHC) qui est indispensable pour les tumeurs de stade II à haut risque qui ne bénéficieraient pas d’un traitement adjuvant et pour la sélection de patients candidats à l’immunothérapie en situation métastatique. L’impact sur le choix d’une biothérapie en première ligne d’un cancer métastatique est moins clair même si le bevacizumab semble avoir un intérêt particulier pour ce profil.
-
Du statut mutationnel de l’oncogène RAS. Une mutation de RAS est prédictive de non efficacité des antiEGFRs (en situation métastatique).
-
Du statut mutationnel de l’oncogène BRAF. La présence d’une mutation BRAF confère à la tumeur un très mauvais pronostic (en situation métastatique) et nécessite d’intensifier la chimiothérapie
L’avenir nous permettra certainement d’affiner ces paramètres biologiques pour définir les meilleurs traitements adaptés à chaque profil moléculaire. La localisation tumorale de la tumeur primitive deviendrait ainsi un paramètre grossier prédictif d’efficacité des traitements notamment des biothérapies antiVEGF et antiEGFR. Dès à présent, elle doit être utilisée comme facteur de stratification dans les essais thérapeutiques.
Références
- Chauvenet M, Cottet V, Lepage C et al. Trends in colorectal cancer incidence: a period and birth-cohort analysis in a well-defined French population. BMC Cancer. 2011(30);11:282.
- Medical Embryology, Langhman 10th edition Embryologie humaine, F. Encha-Razavi, E. Escudier Embryologie humaine, Larsen, 2eme édition.
- Schrag D, Weng S, Brooks G et al. The relationship between primary tumor sidedness and prognosis in colorectal cancer J Clin Oncol 2016;15_suppl:3505.
- Holch JW, Ricard I, Stintzing S et al. The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials. Eur J Cancer 2017;70:87-98.
- Missiaglia E, Jacobs B, G. D’Ario G et al. Distal and proximal côlon cancers differ in terms of molecular, pathological, and clinical features. Ann Oncol 2014;25:1995-2001.
- Yahagi M, Okabayashi K, Hasegawa H et al. The Worse Prognosis of Right-Sided Compared with Left-Sided Côlon Cancers: a Systematic Review and Meta-analysis. J Gastrointest Surg 2016;20:648-655.
- Venook A, Niedzwiecki D, Innocenti F et al. Impact of primary (1°) tumor location on overall survival (OS) and progression-free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405 (Alliance). J Clin Oncol 34, 2016 (suppl;abstr 3504).
- Heinemann V, Dominik Modest DP, Von Weikersthal LF et al. Gender and tumor location as predictors for efficacy: Influence on endpoints in first-line treatment with FOLFIRI in combination with cetuximab or bevacizumab in the AIO KRK 0306 (FIRE3) trial. J Clin Oncol 32:5s, 2014 (suppl;abstr 3600).
- Barault L, Charon-Barra C, Jooste V et al. Hypermethylator phenotype in sporadic côlon cancer: study on a population-based series of 582 cases. Cancer Res 2008;
68:8541-6. - Barault L, Veyrie N, Jooste V et al. Mutations in the RAS-MAPK, PI(3)K (phosphatidylinositol-3-OH kinase) signaling network correlate with poor survival in a population-based series of côlon cancers. Int J Cancer 2008;
122:2255-9. - Guinney J, Dienstmann R, Wang X, et al. The consensus molecular subtypes of colorectal cancer. PLoS Nat Med 2015;21:1350-6.
- Sargent DJ, Marsoni S, Monges G et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in côlon cancer.J Clin Oncol 2010;28(20):3219-26.
- Overman MJ, McDermott R, Leach JL et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet 2017;18:1182-91.
- Bokemeyer C, Van Cutsem E, Rougier P, et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 2012;48:1466-75.
- Cremolini C, Loupakis F, Antoniotti C, et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015, 16(13):1306-1315.
- Phelip JM, Bouché O, Conroy T, Michel P, Penna C, Tournigand C, Chibaudel B, Bedenne L: “Cancer colorectal métastatique”. Thésaurus National de Cancérologie Digestive, juin 2016, [http://www.tncd.org].
- Herrmann S, Tran-Minh My-Linh, Karayan Tapon L, Guilloteau K et al. Impact pronostique de la mutation BRAF dans le cancer colorectal avec et sans instabilité microsatellitaire. ref D Tougeron.
- An Na S, Yoonjin K, Duck-Woo K et al. HER2 Status in Colorectal Cancer: Its Clinical Significance and the Relationship between HER2 Gene Amplification and Expression. PLoS One 2014;9(5) e98528.
- Siena S , Sartore-Bianchi A , Lonardi S et al. Trastuzumab and lapatinib in HER2-amplified metastatic colorectal cancer patients (mCRC): The HERACLES trial. J Clin Oncol 2015;33, (suppl 15):3508.
- Stintzing S, Wirapati P, Lenz HJ et al. Consensus Molecular Subgroups (CMS) of Colorectal Cancer (CRC) and 1st Line Efficacy of FOLFIRI Plus Cetuximab or Bevacizumab: Analysis of the FIRE-3 (AIO KRK 0306) Study. J Clin Oncol 2017 (suppl 35);abstr 3510.
- Laurent-Puig P, Grisoni ML, Volker Heinemann V et al. MiR 31 3p as a predictive biomarker of cetuximab efficacy effect in metastatic colorectal cancer (mCRC) patients enrolled in FIRE-3 study. J Clin Oncol 2016;34, (suppl 15):3516.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION