Séquelles fonctionnelles de la chirurgie des cancers de la jonction œso-gastrique
Objectifs pédagogiques
- Connaître les montages chirurgicaux les plus fréquemment réalisés.
- Connaître les principales séquelles de la chirurgie œso-gastrique, leur prévalence et leurs mécanismes.
- Connaître les moyens d’y remédier.
Pendant des dizaines d’années, l’indication principale de la chirurgie gastrique a été le traitement de la maladie ulcéreuse gastro-duodénale et de ses complications. Avec l’avènement des anti-sécrétoires gastriques puissants, anti H2 puis inhibiteurs de la pompe à protons, et la démonstration du rôle de l’Helicobacter Pylori dans la physiopathologie de la maladie ulcéreuse gastro-duodénale, les indications de la chirurgie gastrique, vagotomie et gastrectomie partielle, dans le traitement de la maladie ulcéreuse gastro-duodénale ont complètement disparu. L’étude des complications fonctionnelles de la chirurgie œso-gastrique concerne actuellement deux situations totalement différentes, la chirurgie carcinologique, d’une part, et la chirurgie bariatrique, d’autre part. Dans cette mise au point, ne seront pas abordées les complications fonctionnelles de la chirurgie bariatrique qui pose des problèmes très particuliers du fait du terrain sur lequel elle est réalisée et de l’association d’un by-pass intestinal dans la majorité des cas.
Plusieurs facteurs sont à prendre en compte pour étudier les complications fonctionnelles de la chirurgie du cancer de la jonction œso-gastrique (JOG). Premièrement, la stratégie thérapeutique des cancers de la jonction œso-gastrique repose de plus en plus sur une approche combinée, associant à la chirurgie, soit une chimiothérapie péri-opératoire, soit plus rarement une radio-chimiothérapie concomitante, voire une chimiothérapie postopératoire [1]. Il existe une interaction complexe entre les complications de la chirurgie et les effets secondaires du traitement adjuvant et néo-adjuvant. En effet, les effets secondaires de la (radio)-chimiothérapie aggravent la sévérité et le retentissement des complications fonctionnelles de la chirurgie de résection ; inversement, les complications fonctionnelles de la chirurgie, plus fréquentes et plus sévères en post-opératoire immédiat, altèrent l’état général des malades et rendent difficile voire impossible la réalisation du programme thérapeutique complet initialement prévu. Dans les grandes études randomisées démontrant l’intérêt d’une chimiothérapie péri-opératoire dans le traitement du cancer gastrique, moins de 50 % des malades du bras radiothérapie ont pu recevoir l’ensemble des cures initialement prévues [2, 3]. L’interprétation des études sur les complications fonctionnelles de la chirurgie des cancers de la JOG est par ailleurs rendue difficile par les conséquences des récidives tumorales qui peuvent entraîner l’apparition de différents symptômes à type de dysphagie, de dyspepsie, d’anorexie et de perte de poids, indépendamment de toute complication liée au montage chirurgical lui-même. Le mauvais pronostic global des cancers de la JOG explique qu’il existe peu d’études dans la littérature faisant état d’un recul de plus de 3 à 5 ans.
Les différentes interventions chirurgicales
Les cancers du bas-œsophage et du cardia sont regroupés au sein des cancers de la jonction œso-gastrique. Le type d’intervention réalisé pour le traitement des cancers de la JOG dépend avant tout de la localisation de la tumeur. La classification des cancers de la JOG la plus utilisée est celle de Siewert et al. [4] qui distingue i) les cancers de type I, ou adénocarcinomes du bas-œsophage qui se développent habituellement sur un endobrachyœsophage, ii) les cancers de type II qui sont de vrais cancers du cardia et enfin, iii) les cancers de type III qui correspondent à des adénocarcinomes de l’estomac sous-cardial. Sur le plan chirurgical, les cancers de type I sont traités comme des cancers de l’œsophage ; les cancers de type III comme des cancers de l’estomac. La modalité chirurgicale pour des cancers de type II reste plus controversée [1, 5].
Dans tous les cas, l’objectif de la chirurgie est de permettre d’obtenir l’efficacité maximale sur le plan carcinologique avec la morbi-mortalité la plus faible et la survenue de séquelles fonctionnelles les moins invalidantes possibles.
Œso-gastrectomie polaire supérieure
Cette intervention, recommandée pour les cancers de la jonction œso-gastrique de type I, est réalisée préférentiellement par voie trans-thoracique droite avec plastie gastrique et anastomose œso-gastrique à la partie supérieure du thorax ou au cou. Une alternative est représentée par la voie trans-hiatale avec une anastomose au cou sans thoracotomie, intervention réservée aux malades à plus haut risque avec contre-indication à la voie trans-thoracique. La thoraco-phréno-laparotomie gauche avec anastomose sous la crosse de l’aorte n’est plus utilisée. Différentes modalités de confection de la plastie gastrique ont été proposées pour tenter de limiter les conséquences fonctionnelles de l’intervention chirurgicale.
Gastrectomie totale
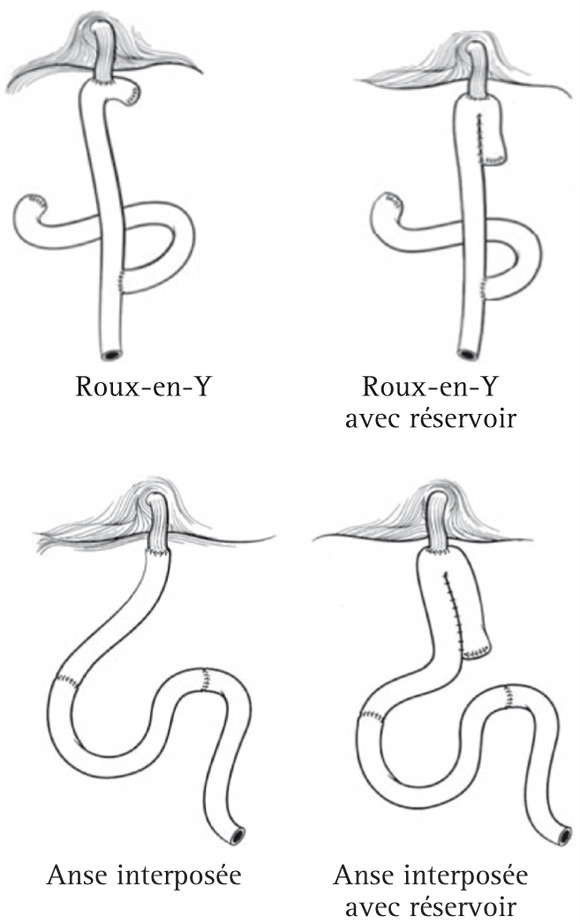
C’est actuellement l’intervention de référence pour les cancers de type II et III. Plus de 90 montages ont été proposés pour rétablir la continuité digestive et tenter de limiter les conséquences fonctionnelles de la résection gastrique [6]. Les montages les plus utilisés sont représentées dans la figure 1 :
- Anse jéjunale montée en Y selon Roux. Il s’agit de l’intervention la plus simple et la plus utilisée. L’anse montée en pré-colique ou en trans-méso-colique doit avoir une longueur minimale de 40 cm et ne pas excéder 60 cm. Le rétablissement au pied de l’anse est réalisé par une anastomose jéjuno-jéjunale. L’anastomose œso-jéjunale est de type termino-latérale avec constitution d’un cul de sac le plus court possible (2-3 cm). Elle peut être réalisée à la main ou à l’aide d’une pince mécanique.
- Interposition jéjunale. Une anse jéjunale est interposée entre l’extrémité inférieure de l’œsophage et le duodénum. L’objectif de cette intervention plus complexe est de rétablir un circuit digestif « normal » et d’éviter les conséquences théoriquement néfastes du court-circuit du duodénum et du jéjunum proximal secondaire à la création d’une anse en Y.
- Création d’un néo-réservoir (« pouch ») par plicature en U du jéjunum pour tenter de limiter les conséquences de la perte de la fonction de réservoir de l’estomac. Ce réservoir peut être confectionné soit à l’extrémité supérieure d’une anse en Y montée selon Roux, soit au pied d’une anse jéjunale interposée. Ce montage ne modifie pas le résultat fonctionnel à court et moyen termes. En revanche la création d’un réservoir est associée à une meilleure qualité de vie avec un recul de 3 à 5ans et cette intervention doit être envisagée chez les malades avec une espérance de vie prolongée [6-8].
Figure 1. Les différents montages chirurgicaux après gastrectomie totale
Gastrectomie proximale
Cette intervention réservée aux cancers de type II est peu réalisée en pratique courante. Le rétablissement de la continuité digestive est réalisé par une anastomose œso-gastrique.
Les conséquences fonctionnelles de la gastrectomie distale ne seront pas abordées puisque cette intervention n’est jamais réalisée dans le traitement d’un cancer de la jonction œso-gastrique.
Physiopathologie des complications fonctionnelles postchirurgicales
Les complications fonctionnelles de la chirurgie des cancers œso-gastriques sont liées à différents facteurs qui peuvent être isolés ou associés chez un même malade : perte ou perturbation de la fonction motrice de l’estomac ; altération de la fonction sécrétoire gastrique ; conséquences de la vagotomie ; conséquences du court-circuit duodéno-jéjunal ; complications liées au montage chirurgical
Fonction motrice de l’estomac
L’activité motrice de l’estomac joue un rôle important dans la digestion par une action mécanique de malaxage des aliments et par la régulation du passage du bol alimentaire dans le duodénum-jéjunum. Cette régulation est assurée par le stockage des aliments au niveau du fundus en période post-prandiale puis par l’évacuation régulière du contenu gastrique grâce à la motricité antrale. L’arrivée des aliments dans l’estomac s’accompagne d’une relaxation adaptative du fundus qui permet une augmentation du volume gastrique sans augmentation de la pression intra-gastrique. La relaxation fundique est contrôlée par un réflexe vago-vagal qui induit une stimulation de récepteurs moteurs inhibiteurs de l’estomac proximal. Les gastrectomies proximales ou totales entraînent obligatoirement une perte de cette capacité de stockage post-prandial des aliments qui sont donc évacués anormalement rapidement dans le tube digestif supérieur. La création dans certains montages chirurgicaux d’un néo-réservoir jéjunal (« pouch ») a pour objectif théorique de restaurer cette fonction de réservoir [6-8]. Au niveau antral, les contractions musculaires fragmentent les grosses particules alimentaires en de plus petites particules de 1 à 2 mm qui peuvent passer le pylore et arriver dans le duodénum. Cette fonction motrice antrale disparaît en cas de gastrectomie totale.
La principale conséquence fonctionnelle de la chirurgie des cancers de la JOG sur le plan moteur est donc la perturbation de la régulation de l’évacuation gastrique et l’arrivée rapide et massive du bol alimentaire hyperosmolaire dans le duodéno-jéjunum. Ce phénomène représente le mécanisme physiopathologique principal du dumping syndrome. En cas de gastrectomie proximale, la diminution du réservoir gastrique et la perturbation de la relaxation adaptative fundique expliquent la sensation de petit estomac avec une sensation de satiété précoce en post-prandial immédiat. Le contrôle vagal de la relaxation fundique et de la motricité antrale explique, en partie, les modifications de la motricité de la plastie gastrique réalisée au cours des résections œsophagiennes qui comportent la réalisation systématique d’une vagotomie (cf. ci-dessous).
Fonction sécrétoire gastrique
La gastrectomie totale est associée à une suppression de la sécrétion gastrique acide et de la production de facteur intrinsèque, de pepsine et de lipase. Les conséquences fonctionnelles et nutritionnelles de la perte de la fonction sécrétoire gastrique sont multiples :
- Perturbation de l’absorption de la vitamine B12 par suppression de la production du complexe vitamine B12 – facteur intrinsèque gastrique, normalement absorbé au niveau de l’iléon terminal.
- Réduction de l’absorption du fer et du calcium qui ne sont pas ionisés par la sécrétion gastrique acide.
- La suppression de la sécrétion gastrique acide a également des conséquences en terme d’écologie bactérienne avec notamment un risque accru d’infection à Clostridium difficile et de pullulation intestinale du grêle dont les conséquences sont surtout marquées en cas d’anse borgne ou de sténose du grêle associées. La suppression de la sécrétion gastrique acide peut entraîner une moindre stimulation de la sécrétion pancréatique. L’insuffisance pancréatique fonctionnelle est cependant avant tout liée au court-circuit duodéno-jéjunal lié au montage chirurgical. La suppression de la sécrétion de lipase et de trypsine n’a pas de conséquence en pratique clinique.
Vagotomie
La chirurgie du cancer de la jonction œso-gastrique s’accompagne obligatoirement d’une vagotomie tronculaire qui, par elle-même, peut aggraver les conséquences de la résection œso-gastrique : troubles de la motricité gastrique (cf. supra), mais surtout troubles de la motricité intestinale qui peut représenter un des mécanismes physiopathologiques de la diarrhée post-résection œso-gastrique et expliquer dans certains cas la résistance au traitement symptomatique de la diarrhée.
Court-circuit duodéno-jéjunal
La gastrectomie totale avec anse jéjunale en Y, intervention la plus pratiquée, entraîne un court-circuit du duodénum et du jéjunum proximal qui jouent physiologiquement un rôle clé dans la régulation de la sécrétion bilio-pancréatique et exercent un rétro-contrôle sur la sécrétion gastrique acide et sur la vidange gastrique. Le court-circuit duodénal peut théoriquement entraîner une insuffisance pancréatique fonctionnelle et majorer les troubles de la vidange gastrique du fait de la suppression du rétro-contrôle duodéno-jéjunal. Le rétablissement de la continuité digestive par interposition d’une anse jéjunale après gastrectomie totale a pour objectif d’éviter les conséquences délétères du court-circuit duodénal. L’absence de démonstration d’un bénéfice de ce type de montage par rapport à une anse en Y suggère qu’il s’agit, en pratique, d’un mécanisme accessoire dans la physiopathologie des troubles observés après gastrectomie totale [6, 9].
Conséquences du montage chirurgical lui-même
Les principales complications liées au montage chirurgical sont :
Sténose anastomotique
Il s’agit d’une complication très fréquente. L’incidence varie selon les études entre 20 et 30 % après œsophagectomie et 10 à 15 % après gastrectomie. Les sténoses peuvent survenir de manière décalée après l’intervention et la dysphagie apparaître qu’après un délai de 2 mois. L’ischémie au niveau de la tranche de section est la cause principale de la survenue d’une sténose anastomotique. Certaines études suggèrent un risque accru de sténose en cas de fistule anastomotique, ce résultat n’étant pas retrouvé par d’autres auteurs.
Troubles de la motricité au niveau du tube gastrique en cas de résection de l’œsophage ou de l’anse jéjunale en Y en cas de gastrectomie totale
Après œsophagectomie, plusieurs facteurs sont susceptibles de perturber la motricité du tube gastrique anastomosé à l’œsophage en intra-thoracique : diminution de la vascularisation de 10 à 20 % du fait des ligatures artérielles, réduction de la capacité du tube, modification de l’innervation du fait de la vagotomie tronculaire associée. La réalisation d’une intervention de drainage au niveau du pylore (« pyloroplastie ») proposée par certaines équipes peut entraîner un reflux bilieux au sein du tube gastrique. Des études isotopiques ont montré que la vidange du tube gastrique est très altérée chez près d’un tiers des malades mais que ces perturbations ont tendance à diminuer avec le temps [10].
Après gastrectomie totale, la motricité de l’anse montée en Y peut également être modifiée du fait de la section intestinale qui entraîne une perturbation de la stimulation des contractions qui partent normalement au niveau du duodénum. Des pace-makers ectopiques peuvent se mettre en place au niveau de l’anse montée et entraîner la survenue de contractions rétrogrades qui expliquent la survenue d’une stase au niveau de l’anse et la survenue de vomissements dans les formes les plus sévères [11]. La signification de ces anomalies motrices reste cependant controversée puisqu’elles s’observent aussi bien chez les sujets symptomatiques que chez les sujets asymptomatiques [12].
Les différentes complications fonctionnelles
Dumping syndrome
Le dumping syndrome correspond aux symptômes liés à l’arrivée trop rapide des aliments au niveau du jéjunum après chirurgie gastrique et/ou œsophagienne [13-15]. Il survient chez 20 à 50 % des malades après chirurgie gastrique ou œsophagienne avec ou sans vagotomie.
Deux types de dumping syndrome peuvent être individualisés en fonction du délai de survenue par rapport aux repas :
- Le dumping syndrome précoce associe des signes digestifs et des signes généraux survenant en période post prandiale immédiate, voire avant la fin du repas. Les symptômes digestifs les plus fréquents sont les douleurs abdominales, la diarrhée, les borborygmes, les ballonnements et les nausées. Les signes généraux associent sueurs, sensation de malaise, flush, palpitations, hypotonie et, dans les formes les plus sévères, une syncope. Elément sémiologique important : ces symptômes sont prévenus ou atténués par le décubitus.
- Dans le dumping syndrome tardif, la symptomatologie clinique, liée à la survenue d’une hypoglycémie une à deux heures après la fin du repas, associe asthénie, sueurs, palpitations, sensation de faim, troubles du comportement à type d’agressivité, tremblements et syncope.
L’histoire naturelle du dumping syndrome est controversée. Certaines études suggèrent une amélioration spontanée des troubles chez une majorité des patients alors que, dans d’autres études, le dumping syndrome peut persister au-delà de plusieurs années. Néanmoins en pratique clinique, dans l’immense majorité des cas, les symptômes régressent en quelques mois et les formes sévères de dumping syndrome ne se rencontrent que chez une minorité de patients.
Le diagnostic de dumping syndrome est avant tout clinique. La survenue en période post prandiale de signes cliniques et généraux, dans la suite d’une résection œso-gastrique ou après une vagotomie, suffit à affirmer le diagnostic. La mise en évidence d’une hypoglycémie associée aux symptômes renforce l’hypothèse diagnostique. Un test de provocation par ingestion de 50 à 75 g de glucose est rarement réalisé en pratique clinique. Ce test est considéré comme positif en cas d’augmentation précoce (30 minutes) et supérieure à 3 % de l’hématocrite et/ou de survenue tardive d’une hypoglycémie (120 ou 180 minutes). Une augmentation de la fréquence cardiaque de plus de 10 bpm après 30 minutes serait également un bon marqueur diagnostique de dumping syndrome. Les tests de vidange gastrique ne sont d’aucune utilité clinique.
La physiopathologie du dumping syndrome reste en partie incomprise mais il est admis que le dumping syndrome précoce et le dumping précoce tardif correspondent à des mécanismes différents [13].
- Dans le dumping syndrome précoce, l’arrivée rapide du bol alimentaire hyperosmolaire dans le duodéno-jéjunum induirait les symptômes par deux mécanismes différents, un phénomène osmotique d’une part et un mécanisme hormonal d’autre part. L’appel d’eau dans la lumière intestinale, par un phénomène osmotique, serait responsable, d’une part, d’une distension du grêle et d’une diarrhée osmotique et, d’autre part, d’une hypovolémie à l’origine des signes généraux. Sur le plan hormonal, l’arrivée rapide du bol alimentaire dans le jéjunum entraînerait une sécrétion accrue des différents peptides gastro-intestinaux comme le peptide YY, le GLP1, le VIP, le polypeptide pancréatique et l’entéroglucagon. Ces peptides seraient responsables des signes cliniques par leurs effets hémodynamiques et des symptômes digestifs par leurs actions sur la motricité et la sécrétion intestinales.
- Le dumping syndrome tardif est lié à une hypoglycémie réactionnelle secondaire à une stimulation excessive de la sécrétion d’insuline par l’arrivée trop rapide d’une charge d’hydrates de carbone élevée dans le duodénum. Le GLP1 pourrait être un autre médiateur de la survenue d’une hypoglycémie tardive.
Le traitement du dumping syndrome repose avant tout sur des mesures diététiques. Compte tenu d’évolution spontanément favorable chez une majorité de malades, les traitements médicaux ne se discutent qu’en cas de symptomatologie invalidante et d’échec des mesures diététiques. La prise en charge diététique des malades est axée sur le fractionnement des repas, la diminution des apports hyperosmolaires et la réduction de l’apport de liquide au cours des repas. Il peut être utile de recommander aux malades de s’allonger systématiquement après le repas pour réduire la sévérité des symptômes. En seconde intention, il est possible d’essayer de ralentir la vidange gastrique par l’adjonction de pectine et de gomme guar à l’alimentation. En cas de dumping sévère, il est possible de prescrire des analogues de la somatostatine, de préférence sous forme retard, qui ont fait la preuve de leur efficacité sur les symptômes, la courbe glycémique et sur le pouls. L’efficacité des analogues de la somatostatine est liée à leur effet ralentisseur sur la vidange gastrique et la motricité intestinale et à leur action inhibitrice sur la sécrétion d’insuline et des peptides gastro-intestinaux responsables de la survenue du dumping syndrome. La chirurgie ne se discute que très rarement, chez les malades atteints de formes sévères, invalidantes et résistantes aux mesures diététiques habituelles et aux analogues de la somatostatine. Diverses interventions chirurgicales ont été proposées, telles que la réalisation d’anses « reverse ». Leur résultat est inconstant et imprévisible de telle sorte que les indications doivent être mûrement réfléchies et faire l’objet d’une discussion en réunions de concertation pluridisciplinaires
Diarrhée
La diarrhée post-résection œso-gastrique est liée, comme nous l’avons vu, avant tout à un mécanisme osmotique du fait de l’arrivée trop rapide dans le jéjunum d’un bol alimentaire hyperosmolaire. Néanmoins, d’autres facteurs peuvent être responsables de la diarrhée, soit isolément, soit le plus souvent associés à un mécanisme osmotique :
- Une insuffisance pancréatique exocrine, secondaire au court-circuit intestinal, peut-être responsable d’une diarrhée de malabsorption. L’insuffisance pancréatique fonctionnelle peut être également secondaire à la malnutrition et à la diminution physiologique de la masse pancréatique fonctionnelle chez le sujet âgé. En pratique clinique, l’insuffisance pancréatique joue un rôle souvent accessoire et ne justifie pas la prescription systématique d’extraits pancréatiques après chirurgie œso-gastrique [16].
- La pullulation microbienne du grêle est favorisée par la constitution d’anses borgnes et par la suppression de la sécrétion gastrique acide. En cas de suspicion de pullulation microbienne à l’origine d’une diarrhée post-chirurgicale, deux attitudes peuvent être envisagées, soit la réalisation d’un breath test au glucose pour affirmer la colonisation bactérienne du grêle, soit un traitement d’épreuve par antibiotiques.
- La vagotomie tronculaire entraîne une perturbation de la motricité du grêle qui peut aggraver la diarrhée dans le cadre d’un dumping syndrome voire expliquer la résistance aux traitements de la diarrhée dans les formes les plus sévères.
Dysphagie
La dysphagie est une complication très fréquente au décours de la chirurgie du cancer de la JOG. Elle est liée dans plus de 90 % des cas à une sténose dont la survenue peut être décalée jusqu’à 2 mois après l’intervention chirurgicale. La sténose est plus fréquente après œsophagectomie qu’après gastrectomie. Il n’y a pas de corrélation stricte entre le degré de la sténose et l’importance de la dysphagie. Toute dysphagie survenant au décours d’une chirurgie pour un cancer de la JOG, doit faire rechercher une récidive tumorale loco-régionale responsable d’une prolifération endoluminale et/ou d’une compression extrinsèque et justifie la réalisation d’une fibroscopie œso-gastro-duodénale, d’un scanner thoraco-abdomino-pelvien et éventuellement d’une écho-endoscopie. Le traitement de première intention des sténoses anastomotiques repose sur les dilatations per-endoscopiques. Celles-ci doivent être répétées et, en moyenne, les malades bénéficient de plus de 3 séances de dilatation. En l’absence de sténose et de récidive tumorale, la dysphagie peut être due soit à une œsophagite liée au reflux, soit à un trouble de la motricité au niveau de la plastie gastrique en particulier en cas d’anastomose œso-gastrique intra-thoracique. Il est essentiel de traiter efficacement la dysphagie pour éviter l’apparition ou l’aggravation d’une dénutrition en post-opératoire.
Syndrome de l’anse en Y de Roux et symptômes liés à la stase dans la plastie gastrique
Après gastrectomie totale et anastomose œso-jéjunale sur une anse jéjunale montée en Y, environ un tiers des malades de plaint d’une symptomatologie plus ou moins sévère, associant une sensation de distension et de plénitude épigastriques, des douleurs abdominales, des nausées et, dans les formes les plus sévères, des vomissements. On parle de « syndrome de l’anse en Y de Roux » Ces malades se plaignent également très fréquemment d’une symptomatologie de reflux. Les troubles sont nettement aggravés en période post-prandiale. Le syndrome de l’anse en Y s’explique par les troubles de la motricité intestinale au niveau de l’anse montée et est favorisé par la confection d’une anse trop longue, supérieure à 60 cm. En dehors des mesures diététiques pour fractionner l’alimentation, les possibilités thérapeutiques sont limitées. Des résultats favorables ont été rapportés avec la stimulation électrique de l’anse montée, par analogie avec la stratégie utilisée dans la gastroparésie, mais cette technique reste encore du domaine expérimental [17].
Une symptomatologie similaire à celle du syndrome de l’anse en Y de Roux (sensation de pesanteur thoracique ou épigastrique majorée en période post-prandiale, associée à des nausées voire à des vomissements et à des épisodes fréquents de reflux gastro-œsophagien) est parfois observée après œsophagectomie et anastomose œso-gastrique. Ces troubles sont liés aux troubles de la motricité du transplant gastrique et peuvent mettre en jeu le pronostic en favorisant la survenue de pneumopathies d’inhalation à répétition. Les prokinétiques peuvent être essayés mais leur efficacité est souvent limitée. Certains auteurs ont suggéré que ces troubles seraient moins fréquents et moins intenses en cas d’anastomose œso-gastrique haut située dans le thorax [18]. Le calibre du tube gastrique pourrait également jouer un rôle dans la physiopathologie des troubles et certains auteurs ont proposé la réalisation d’un tube gastrique calibré de 3 à 4 cm de diamètre. Les arguments pour l’utilisation d’un tube gastrique plus étroit sont un moindre risque de dilatation, une meilleure préservation des fonctions motrices et une moindre rétention des liquides [19].
Reflux
Le reflux est un des symptômes qui altère le plus la qualité de vie des malades après chirurgie du cancer de la JOG [20]. Plus de 50 % des malades se plaignent de reflux après chirurgie. La sévérité est difficile à évaluer car les scores utilisés varient d’une étude à l’autre. La survenue d’un reflux est liée à la suppression au cours de la résection de la tumeur des mécanismes de continence physiologiques anti-reflux et à l’absence de méthodes de reconstruction recréant un système anti-reflux. Le reflux est le plus fréquent et le plus sévère après gastrectomie proximale et anastomose œsogastrique. La sévérité du reflux dans cette situation particulière est un des facteurs qui explique que cette intervention soit moins pratiquée actuellement dans les cancers de la JOG de type III. Après gastrectomie totale, le reflux est fréquent et parfois associé à un syndrome de l’anse montée de Roux. Après œsogastrectomie polaire supérieure un reflux survient chez près de 60 % des malades quelque soit le montage réalisé. Dans tous les cas, il s’agit d’un reflux biliaire et la prescription d’un traitement anti-sécrétoire n’est pas indiquée.
Conséquences nutritionnelles
Le traitement chirurgical des cancers de la jonction œso-gastrique a un retentissement nutritionnel majeur. La perte de poids moyenne est de 7 à 15 % après gastrectomie totale et de 10 à 15 % après œsophagectomie [21]. La perte de poids est maximale dans les 6 premiers mois post-opératoires mais aucune récupération n’est habituellement observée dans les années suivantes [22]. La dénutrition tend même à s’aggraver au fil du temps. Dans une étude sur 203 malades opérés d’un cancer de l’œsophage ayant survécu plus de 3 ans, la perte de poids à 6 mois était similaire entre les patients survivants et les patients décédés à 3 ans. L’existence d’une obésité en préopératoire est un facteur de risque majeur de dénutrition en post-opératoire avec un risque multiplié par 6. Le stade de la tumeur n’est pas prédictif de la perte de poids à 6 mois.
Plusieurs études ont montré qu’une assistance nutritionnelle était susceptible de limiter les conséquences nutritionnelles de la chirurgie œso-gastrique [23]. Une telle approche est essentielle puisqu’il existe une corrélation entre la qualité de vie et l’état nutritionnel chez les malades cancéreux [24].
Conclusion
Les conséquences fonctionnelles de la chirurgie du cancer de la JOG sont très fréquentes. Elles ont un impact majeur sur la qualité de vie des malades qui reste très fortement altérée plusieurs années après la chirurgie [25]. Les mesures préventives ont une efficacité limitée en dehors de la confection d’un réservoir jéjunal après gastrectomie totale qui améliore la qualité de vie à long terme. La prise en charge des complications fonctionnelles et du retentissement nutritionnel de la chirurgie du cancer de la JOG est essentielle afin de limiter leur impact sur la qualité de vie et d’augmenter la « faisabilité » des traitements adjuvants conformément aux recommandations actuelles.
Références
- Mariette C, Piessen G, Briez N, et al. Oesophagogastric junction adenocarcinoma: which therapeutic approach? Lancet Oncol 2011;12:296-305.
- Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for respectable gastroesophageal cancer. N Engl J Med 2006;355:11-20.
- Ychou M, Boige V, Pignon JM, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD Multicenter Phase III trial. J Clin Oncol 2011;29:1715-1721.
- Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998;85:1457-59.
- Recommandations de la SFCD et de l’ACHBT. Cancérologie digestive : pratiques chirurgicales. J Chir 2009;146(sup 2):S11-S80.
- Piessen G, Triboulet JP, Mariette C. Reconstruction after gastrectomy: which technique is best? J Visc Surg 2010;147:e273-e283.
- Gertler R, Rosenberg R. Feith M, et al. Pouch vs. No pouch following total gastrectomy: meta-analysis and systematic review. Am J Gastroenterol 2009;104:2838-51.
- Ishigami S, Natsugoe S, Hokita S, et al. Posteoperative long-term evaluation of interposition reconstruction compared with Roux-en-Y after total gastrectomy in gastric cancer: prospective randomized controlled trial. Am J Surg 2011;202:247-53.
- Lehnert T, Kuhl K. Techniques of reconstruction after total gastrectomy for cancer. Br J Surg 2004;91:528-529.
- Hyun Sung L, Moon Soo K, Jong Mog L, et al. Intrathoracic gastric emptying of solid food after esophagectomy for esophageal cancer. Ann Thorac Surg 2005;80:44.3-8.
- Ducrotté P, Leblanc I, Denis P. Conséquences motrices de la chirurgie gastrique. Hépato Gastro 1997;4:11-19.
- Miedema BW, Kelly KA, Camilleri M, et al. Human gastric and jejunal transit and motility after Roux gastrojejunostomy. Gastroenterology 1992;103:1133-43.
- Tack J, Arts J, Caenepeel P, et al. Pathophysiology, diagnosis and management of postoperative dumping syndrome. Gastroenterol Hepatol 2009;6:583-590.
- Dikic S, Randjelovic T, Dragojevic S, Bilanovic D, Granic M, et al. Early Dumping syndrome and reflux esphagitis prevention with pouch reconstruction. J Surg Res 2011. [Epub ahead of print].
- Mine S, Sano T, Tsutsumi K, et al. Large-scale investigation into Dumping syndrome after gastrectomy for gastric cancer. J Am Coll Surg 2010;211:628-636.
- Brägelmann R, Armbrecht U, Rosemeyer D, et al. The effect of pancreatic enzyme supplementation in patients with steatorrhoea after total gastrectomy. Eur J Gastroenterol Hepatol 1999;11:231-37.
- Daram SR, Tang SJ, Vick K, et al. Novel application of GI electrical stimulation in Roux stasis syndrome (with video). Gastrointest Endosc 2011;74:683-686.
- Hu J. Li R, Sun L, Ni Y. Influence of esophageal carcinoma operations on gastroesophageal reflux. Ann Thorac Surg 2004;78:298-302.
- Zhang C, Wu QC, Hou PY, et al. Impact of the method of reconstruction after oncologic oesophagectomy on quality of life – a prospective, randomized study. Eur J Card Thor Surg 2011;39:109-114.
- Yoo CH, Sohn BH, Han WK, et al. Long-term results of proximal and total gastrectomy for adenocarcinoma of the upper third of the stomach. Cancer Res Treat 2004;36:50-55.
- Carey S, Storey D, Biankin AV, Martin D, Young J, et al. Long term nutritional status and quality of life following major upper gastrointestinal surgery – A cross-sectional study. Clin Nutr 2011;30:774-779.
- Martin L, Lagergren P. Long-term weight change after oesophageal cancer surgery. Br J Surg 2009;96:1308-14.
- Hytlander A, Bosaesus I, Svedlund J, et al. Supportive nutrition on recovery of metabolism, nutritional state, health-related quality of life, and exercise capacity after major surgery: a randomized study. Clin Gastroenterol Hepatol 2005;3:466-474.
- Nourissat A, Vasson MP, Merrouche Y, et al. Relationship between nutritional status and quality of life in patients with cancer. Eur J Cancer 2008; 44:1238-1242.
- McLarty AJ, Deschamps C, Trastek VF, et al. Esophageal resection for cancer of the esophagus: Long-term function and quality of life. Ann Thorac Surg 1997;63:1568-71.
Les 5 points forts
- Elles sont très fréquentes en post-opératoire et régressent de manière inconstante et incomplète avec le temps.
- Elles retentissent de manière majeure sur l’état nutritionnel.
- À court terme, elles peuvent compromettre la réalisation des traitements adjuvants (chimiothérapie ou radio-chimiothérapie) chez environ la moitié des malades.
- À long terme, elles altèrent la qualité de vie de manière pérenne.
- Seule la réalisation d’un réservoir jéjunal après gastrectomie totale a fait la preuve de son efficacité pour améliorer la qualité de vie au long cours.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION