Traitement du RGO : indications de la chirurgie
Objectifs pédagogiques
- Connaître les bonnes et les mauvaises indications de la chirurgie antireflux.
- Quel type de chirurgie ?
- Quels résultats (complications et qualité de vie) à moyen et long terme ?
Introduction
La première fundoplicature selon Nissen par laparoscopie a été faite il y a un peu plus de 20 ans. Sous prétexte de chirurgie mini-invasive, d’excellente vision de la région hiatale et de réduction des coûts, la chirurgie antireflux a connu un essor exponentiel, la laparoscopie étant définie comme le gold standard sur le plan technique par la conférence de consensus de 1999, alors même que les IPP supplantaient les anti-H2. Le désenchantement débuta avec les premières évaluations à moyen terme montrant une augmentation progressive du taux de réintervention (Fig 1), la fréquence des effets secondaires et séquelles de cette chirurgie, particulièrement la dysphagie et les résultats des études prospectives randomisées comparant les résultats à moyen et long termes de la chirurgie et du traitement médical. Le pic des interventions antireflux s’est situé en France comme aux Etats-Unis au début des années 2000 avec ensuite une décroissance d’environ 50% (Fig 2).
Figure 1 : Taux publié de réinterventions après chirurgie antireflux et année de publication
Figure 2 : Nombre annuel d’interventions antireflux en France. Source : PMSI
L’analyse des données sur la chirurgie antireflux est difficile pour cette maladie fonctionnelle polymorphe avec des groupes de patients hétérogènes et pas toujours comparables d’une étude à l’autre ; la classification endoscopique de l’œsophagite a changé ; l’utilisation de la pH impédancemétrie n’a permis que récemment de mieux démembrer le groupe des patients résistants aux IPP ; il n’y a, pas sauf exception, de standardisation des techniques chirurgicales ; les résultats publiés par les centres experts ne reflètent pas nécessairement la vraie vie et leur extrapolation à la collectivité pose problème.
Le but de ce travail est de faire le point en 2012 sur les indications de la chirurgie antireflux et ses résultats à moyen et long termes particulièrement en qualité de vie.
Chirurgie antireflux : quelles interventions ?
Les fundoplicatures
Le but de toutes les interventions proposées, fundoplicatures ou repositionnement anatomique, est la correction d’une incompétence mécanique du sphincter inférieur de l’œsophage. Cette incompétence mécanique, qui peut être permanente ou transitoire, est en partie liée à des facteurs anatomiques comme la longueur insuffisante de l’œsophage abdominal et le calibre de l’orifice hiatal. Mais interviennent aussi des relaxations inappropriées intermittentes du sphincter inférieur de l’œsophage qui sont liées à la distension gastrique, particulièrement en période postprandiale, et alors déclenchées par un réflexe vago-vagal. La longueur du sphincter inférieur de l’œsophage doit être au moins de 2cm pour qu’il soit efficace et empêche le reflux gastro-oesophagien [1]. L’objectif du traitement chirurgical est donc la « reconstruction » d’un sphincter inférieur de l’œsophage efficace avec une longueur suffisante d’œsophage abdominal, la correction d’une éventuelle hernie hiatale, la reconstitution de l’angle de His et la stabilisation mécanique du montage positionné dans l’enceinte de pression péritonéale. Même si elles paraissaient répondre à ces critères, les interventions de repositionnement anatomique pures n’ont pas fait la preuve de leur efficacité, de la pérennité de leurs résultats et de leur reproductibilité. Seules les fundoplicatures qui utilisent la grosse tubérosité pour envelopper totalement ou partiellement l’œsophage abdominal sont maintenant utilisées. Si on leur attribue un rôle de valve pneumatique qui transmettrait à l’œsophage abdominal la pression du fundus gastrique, elles ont aussi, et peut être principalement, un rôle de stabilisation souple du sphincter inférieur de l’œsophage en position intra-abdominale. La qualité de cette stabilisation et aussi sa souplesse sont probablement des points techniques importants, posant problème en terme de reproductibilité, quand on sait la mobilité de l’œsophage en cours de déglutition et celle du hiatus puisque le diaphragme sur lequel s’appuie cette fixation se contracte à chaque inspiration au rythme d’environ 15 000 fois /j. On notera que toutes les fundoplicatures, de par l’utilisation de la grosse tubérosité pour leur construction, induisent des troubles de la vidange gastrique qui peuvent aussi être aggravés par une lésion per-opératoire des troncs des nerfs pneumogastriques satellites de l’œsophage abdominal et donnant leurs branches au niveau du cardia.
Initialement décrites par laparotomie, les fundoplicatures sont toutes réalisables et réalisées actuellement par laparoscopie dont les contrindications, d’ordre anesthésique ou liées aux antécédents chirurgicaux abdominaux, sont rares. Douze études randomisées et une métaanalyse ont montré des résultats fonctionnels équivalents pour les deux voies d’abord, mais pour la laparoscopie une durée d’hospitalisation plus courte, une reprise d’activité plus précoce, moins de complication et une plus grande fréquence de réintervention [2, 3]. Trois types d’intervention ont été décrits : la fundoplicature totale circulaire dite opération de NIssen (Fig 3), la fundoplicature partielle postérieure dite opération de Toupet enveloppant l’œsophage entre 180° et 270° (Fig 4) et la fundoplicature antérieure dite opération de Dor. La difficulté de leur standardisation et le nombre incalculable de variantes imaginées par les chirurgiens rendent toujours difficile la comparaison des résultats publiés, surtout dans les études multicentriques, l’étude LOTUS où la standardisation de la fundoplicature était un prérequis faisant exception [4]. Beaucoup de publications rapportent des expériences monocentriques qui posent alors le problème de la généralisation des résultats obtenus [5].
Figure 3 : Fundoplicature totale circulaire
Figure 4 : Fundoplicature partielle postérieure
En préopératoire il est habituellement recommandé de prescrire une manométrie pour éliminer une achalasie ou une sclérodermie sévère; des anomalies mineures de la motricité œsophagienne sont banales en cas de reflux. Cependant il n’y a pas d’argument objectif pour moduler l’enveloppement de l’œsophage par la fundoplicature en fonction de ces troubles moteurs. Le transit œsogastroduodénal est utile dans deux situations : a/ en cas d’éléments cliniques ou endoscopiques faisant suspecter une hernie hiatale mixte avec une composante paraœsophagienne ; b/ quand les caractéristiques du reflux (ancienneté, intensité de l’œsophagite en endoscopie) font craindre l’existence d’un brachyœsophage empêchant l’abaissement du cardia en position intra-abdominale et donc la réalisation d’une fundoplicature, cette situation devant faire prévoir une endoscopie per-opératoire. L’abord laparoscopique donne une excellente vision de la région hiatale qui est vue de face. L’intervention comprend la dissection de l’orifice hiatal en respectant le périmysium des piliers, la libération de la face postérieure de l’œsophage puis du cardia, la mobilisation de l’œsophage médiastinal inférieur en repérant les troncs des pneumogastriques et la réalisation de la fundoplicature qui est ensuite suturée selon son type (totale circulaire ou partielle) aux piliers du diaphragme et à l’œsophage abdominal ; les piliers ayant été rapprochés en arrière de l’œsophage sans le sténoser. Le degré de serrage des piliers est apprécié de façon subjective par l’opérateur et il n’existe pas dans la littérature de recommandation pour calibrer ce rétrécissement de l’orifice hiatal. Quel que soit le type de fundoplicature, elle doit être impérativement faite aux dépens de la grosse tubérosité et non avec la face antérieure et la grande courbure de la partie haute du corps gastrique, malfaçon technique propre à la laparoscopie particulièrement pour la fundoplicature totale circulaire, la fundoplicature étant alors gastro-gastrique. Il est recommandé que la hauteur de fundoplicature n’excède pas 3 cm. Il ne semble pas utile de réaliser de principe une mobilisation extensive de l’œsophage médiastinal ; 5 études prospectives randomisées et 2 métaanalyses n’ont pas montré d’avantage à la section systématique des vaisseaux courts pour la mobilisation de la fundoplicature et la qualité des résultats sur le reflux; l’utilisation d’un renfort prothétique ou biologique en complément de la suture des piliers n’est pas recommandée [6, 7].
Les opérés n’ont pas de sonde nasogastrique et cette intervention peut être faite en ambulatoire [8]. La faisabilité des fundoplicatures robotique-assistées est documentée mais l’amélioration du service rendu au patient (et à la collectivité) n’est pas évaluée.
Pour la pratique on retiendra
La chirurgie antireflux est une chirurgie de reconstruction anatomique de la jonction œsophago-gastrique.
Elle associe fermeture des piliers du diaphragme, reconstitution de l’œsophage abdominal et fundoplicature utilisant la grosse tubérosité.
Les fundoplicatures les plus utilisées sont la fundoplicature totale circulaire et la fundoplicature partielle postérieure.
Cette intervention est réalisée par laparoscopie, possiblement en ambulatoire, et le principal écueil pour l’analyse de ses résultats est l’absence de standardisation technique.
Complications périopératoires
Les chiffres sont variables en fonction de la date de publication, de l’intégration ou non dans l’analyse des patients opérés pendant la courbe d’apprentissage, du caractère mono ou multicentrique des séries et du volume d’activité des équipes impliquées. La mortalité opératoire est actuellement quasi nulle quelle que soit la fundoplicature réalisée. Dans l’étude du registre du National Surgical Improvement Program de l’American College of Surgeons portant sur 7531 fundoplicatures par laparoscopie, à 30 jours le taux de mortalité opératoire est de 0.19% et celui de la morbidité est de 3.8% [9]. Ces chiffres varient significativement en fonction de l’âge des opérés : le taux de mortalité passe de 0.05% pour un âge <70 ans à 0.8% pour un âge >70 ans (p<0.0001) ; dépendent aussi de l’âge les taux de complications (2.2% avant 50 ans, 3.8% de 50 à 69 ans et 7.3% après 69 ans) et de complications graves (0.8% avant 50 ans, 1.8% de 50 à 69 ans, 3.9% après 69 ans).
Les principales complications per-opératoires spécifiques, en dehors des risques liés à laparoscopie notamment au moment de la création du pneumopéritoine ou de l’introduction du premier trocart, sont la plaie digestive (<2%), l’hémorragie par plaie du foie (plus fréquente en cas de gros lobe gauche stéatosique) ou de la rate nécessitant très exceptionnellement une splénectomie d’hémostase (<2%). Le pneumothorax par ouverture de la plèvre gauche (<3%) est habituellement bien supporté et rapidement régressif, ne nécessitant pas de drainage, le CO2 utilisé pour le pneumopéritoine étant rapidement éliminé. La conversion en laparotomie, dont le patient doit être informé en préopératoire, est le plus souvent motivée par des difficultés de repérage anatomique ou une hémorragie, sa fréquence est lié à l’expérience de l’opérateur et peut être actuellement estimée à moins de 5%. Plusieurs études de registre américaines suggèrent une relation entre les taux de complication et de conversion d’une part et le nombre annuel de fundoplicatures réalisées dans le centre d’autre part [10, 11].
Dans la période postopératoire immédiate la dysphagie et les troubles de vidange de l’estomac sont habituels, survenant une fois sur deux, et régressent habituellement en 6 à 10 semaines [12]. Ils peuvent être atténués par une information pré-opératoire appropriée et des mesures diététiques simples (fractionnement des repas et alimentation mixée), la reprise de l’alimentation sous forme liquide se faisant le jour même de l’intervention. En cas de dysphagie majeure voire d’aphagie se manifestant dès la reprise de l’alimentation, après un transit œsogastroduodénal ou un examen tomodensitométrique balisé identifiant la cause ; sténose du bas œsophage ou hernie para-œsophagienne (Fig 5 et 6) ; il faut au plus vite réopérer pour corriger la malfaçon technique dans de bonnes conditions, tout délai compliquera la procédure du fait de l’inflammation locale et de l’épaississement des parois de l’estomac et de l’œsophage [13].
Figure 5 : TOGD à J1 post-opératoire. Sténose du bas œsophage.
Figure 6 : TDM balisé à J2 post-opératoire. Hernie paraœsophagienne.
Pour la pratique on retiendra
La mortalité péri-opératoire des fundoplicatures par laparoscopie est quasi nulle, le taux de conversion en laparotomie est inférieur à 5%.
La morbidité est en moyenne inférieure à 5% mais dépend de l’âge de l’opéré.
Les troubles digestifs mineurs post-opératoires immédiats, dysphagie ou satiété précoce, sont fréquents et habituellement régressifs en 6 à 10 semaines.
La dysphagie majeure post-opératoire immédiate est liée à une malfaçon technique et doit faire discuter une réintervention immédiate.
Chirurgie antireflux : quels sont les résultats des fundoplicatures ?
Résultats à long terme
Dans toutes les études, les résultats des fundoplicatures sur les manifestations du RGO sont d’autant meilleurs que les manifestations cliniques préopératoires étaient typiques et les patients soulagés par les IPP. Les problèmes posés par les patients avec des manifestations extradigestives prédominantes, notamment ORL ou respiratoires, seront traités au chapitre Cas particuliers. Pour l’analyse des résultats à long terme, ne sont retenues que les séries publiées avec un recul postopératoire de plus de 5 ans, les études prospectives randomisées (fundoplicature totale circulaire versus fundoplicature partielle postérieure, fundoplicatures versus traitement médical) et les métaanalyses. L’appréciation des résultats est essentiellement clinique et peu de publications font état d’évaluation plus objective avec des résultats d’endoscopie, de ph-métrie ou de pH impédancemétrie. Une analyse critique des séries publiées montrent quelles sont méthodologiquement au mieux de niveau 1b (études prospectives randomisées) et le plus souvent de niveau 2b (suivi de cohorte ou études prospectives randomisées avec moins de 80 % des patients inclus suivis) dans la classification d’Oxford.
Dans une étude ouverte multicentrique française enrôlant 1340 patients traités essentiellement par fundoplicatures totale circulaire (n=711) et partielle postérieure (n= 559), avec un suivi moyen de 7.1±1.5 ans, les résultats sur le reflux sont jugés satisfaisants pour 93% des opérés, sans différence liée au type de fundoplicature [14]. Les effets secondaires, essentiellement dysphagie et gas bloat syndrome, sont notés chez 260 opérés (19.4%) qui les considèrent comme mineurs par rapport aux symptômes préopératoires. La dysphagie et le gas bloat syndrome sont significativement plus fréquents (p<0.0001 et p=0.002) après fundoplicature totale circulaire. Une réintervention était nécessaire pour 59 opérés (4.4%), elle était motivée majoritairement par une récidive symptomatique du reflux ou par une complication liée à la fundoplicature, dysphagie ou hernie paraœsophagienne. La reprise du traitement médical concernait 122 opérés (9.1%). Deux autres séries ouvertes monocentriques avec un recul de plus de 10 ans confirment ces données et suggèrent la stabilité des résultats au delà de 5 ans [15, 16]. Une étude prospective randomisée comparant fundoplicature totale circulaire et fundoplicature partielle postérieure, avec un recul moyen de 18 ans, montre un contrôle des manifestations du reflux > 80% sans différence entre les deux techniques, mais le score de dysphagie est meilleur pour la fundoplicature partielle postérieure [17]. Les résultats des bras chirurgicaux de 2 études prospectives randomisées fundoplicature totale circulaire versus IPP sont identiques avec une reprise des IPP pour plus de 10% des opérés [18, 19]. Cette efficacité similaire sur le RGO des deux fundoplicatures a été objectivée dans une étude comportant une pH-impédancemétrie pré et postopératoire [20].
La différence marquante entre ces deux fundoplicatures est le taux d’effets secondaires : dysphagie précoce et tardive, gas bloat syndrome, flatulence et impossibilité d’éructer; à l’avantage significatif (p<0.00001) de la fundoplicature partielle postérieure dans une revue de la littérature regroupant 10 essais avec 1003 opérés particulièrement pour la dysphagie et l’impossibilité d’éructer [21]. Les 3 métanalyses disponibles (11 essais pour 991 interventions, 7 essais pour 791 interventions, 7 essais pour 939 interventions) confirment l’efficacité similaire des deux types de fundoplicature sur le reflux et un avantage significatif de la fundoplicature partielle postérieure pour les effets secondaires [22, 23, 24]. Deux d’entre elle concluent aussi à une plus grande fréquence des réinterventions après fundoplicature totale circulaire. Reste le cas particulier de la fundoplicature partielle antérieure, intervention peu utilisée dont l’efficacité sur le reflux est, sauf dans une étude, bien inférieure à celle des autres fundoplicatures [25, 26].
Les études de qualité de vie utilisent pour l’évaluation des scores spécifiques (GERD-HRQL : GastroEsophageal Reflux Disease Health Related Quality of Life, GIQLI : GastroIntestinal Quality of Life validé en langue française) ou plus généraux comme (SF-36 : Short Form-36 qui étudie 8 dimensions de la qualité de vie, PGWBI : Psychological General Well Being Index). Si dans toutes les études la qualité de vie s’améliore de façon indiscutable à 3 et 5 ans post-opératoires pour les deux fundoplicatures, elle reste toujours inférieure à celle d’une population témoins en bonne santé [27, 28, 29]. Deux études françaises utilisant le GIQLI montrent une amélioration progressive de ce score dans tous les domaines évalués (symptômes, état physique, état émotionnel, relations sociales), jusqu’à 6 ans postopératoires mais il reste significativement inférieur au score de la population en bonne santé à un an et à 6 ans [30, 31]. Une seule étude prospective randomisée compare les résultats des deux types de fundoplicatures en utilisant le score GIQLI, la manométrie et l’impédancemétrie [32]. Les deux techniques améliorent significativement la qualité de vie de façon équivalente, les résultats en manométrie et impédancemétrie sont en faveur de la fundoplicature totale circulaire pour l’élévation de la pression du sphincter inférieur de l’œsophage et le contrôle du reflux, mais la dysphagie et l’impossibilité d’éructer sont moins fréquentes après fundoplicature partielle postérieure.
Les difficultés d’interprétation des symptômes cliniques post-opératoires évocateurs de récidive de reflux, en dehors du cas très particulier des régurgitations, ne permettent pas de porter ce diagnostic sans recours à la ph-mètrie, y compris en cas de reprise du traitement médical (par anti-H2 ou IPP). En effet si la fréquence de cette reprise varie en fonction du recul post opératoire de 15 à 25 %, dans cette population les symptômes ne sont alors soulagés que dans moins de 30% des cas et les études pH-métriques ne prouvent la récidive du RGO que dans 25 % des cas [33, 34]. Dans un article reprenant 23 études et incluant 7599 opérés avec un suivi de 18 mois à 12 ans, la reprise du traitement médical après fundoplicature est constatée en moyenne chez 35% des opérés [35]. Beaucoup de ces études sont d’origine nord américaine où antiH2 et IPP sont en vente libre et c’est dans les études non randomisées (les auteurs les jugeant plus représentatives de la réalité) que ce taux est le plus élevé. L’efficacité de cette automédication qualifiée de réflexe reposerait en partie sur l’effet placebo notamment des IPP. Le critère reprise du traitement médical ne permet donc pas de conclure à l’échec de la fundoplicature.
Pour la pratique on retiendra
Les résultats des fundoplicatures sur le reflux sont d’autant meilleurs que les symptômes pré-opératoires sont typiques.
L’évaluation des résultats à moyen et long terme est essentiellement clinique et à 5-10 ans 90 % des opérés sont considérés comme satisfaits.
La fundoplicature totale circulaire et la fundoplicature partielle postérieure ont des résultats équivalents sur le reflux.
Mais la fundoplicature partielle postérieure donne significativement moins de dysphagie, de Gas Bloat Syndrome et de difficultés à éructer et doit être préférée.
Les fundoplicatures améliorent significativement la qualité de vie des opérés qui cependant reste inférieure à celle de la population témoins.
Après fundoplicature les signes cliniques de reflux et/ou la reprise du traitement médical ne sont pas prédictifs de récidive de reflux.
Echecs et réinterventions
On estime que 7 à 10% des patients ayant eu une fundoplicature seront opérés une seconde fois. Le taux de récidive symptomatique après fundoplicature est diversement apprécié dans les séries en fonction de la durée du suivi post opératoire, il varie de 5 à 15% mais il est probablement sous estimé car les données proviennent essentiellement de séries de réinterventions chirurgicales faites dans des « centres experts » ou d’études prospectives randomisées qui ne sont pas nécessairement le reflet de la vraie vie. Les symptômes cliniques sont le plus souvent des signes de reflux avec pyrosis (55%), des régurgitations (20%) et de la dysphagie (25%). La dysphagie peut s’accompagner d’un retentissement important sur l’état général avec un amaigrissement significatif et représente dans notre expérience le motif majeur de réintervention. En pratique quotidienne l’analyse des symptômes est souvent plus difficile car ils peuvent être intriqués ou associés à des manifestations dyspeptiques et à des troubles de la vidange gastrique séquellaires de la fundoplicature. On rappelle que le critère reprise du traitement médical ne permet pas de conclure à l’échec de la fundoplicature, la valeur prédictive de récidive de reflux du pyrosis n’est que de 40%.
L’évaluation dans cette situation doit permettre de distinguer deux situations : soit il s’agit de la persistance ou la récidive des symptômes préopératoires, soit il s’agit de nouveaux symptômes et particulièrement la dysphagie. Dans la première situation il faut prouver la réalité du reflux, sa nature et sa responsabilité et discuter en cas de négativité du bien fondé du diagnostic initial et de l’indication à la fundoplicature ; l’erreur diagnostique initiale étant le plus souvent une méconnaissance de troubles moteurs de l’œsophage notamment une achalasie. Dans la seconde situation il faut rechercher des anomalies explicatives du montage chirurgical avant de conclure à la responsabilité d’effets secondaires liés à la fundoplicature et ne relevant pas d’un traitement chirurgical. Les anomalies de montage n’étant identifiables que dans 80% des cas, le risque est alors de faire à tort le diagnostic de Gas Bloat Syndrome dont la définition n’est pas consensuelle (satiété précoce, incapacité d’éructer) et dont la prévalence inférieure à 1% a été surestimée.
A l’issue d’une évaluation comportant en fonction de la situation pH-métrie, manométrie, endoscopie et transit œsogastroduodénal, une réintervention sera discutée en cas d’anomalies de la fundoplicature et du hiatus accessibles à une correction chirurgicale. Si en cas de dysphagie majeure liée à une anomalie morphologique du montage chirurgical, la réintervention se discute peu en l’absence d’alternative thérapeutique, en cas de persistance ou récidive authentifiée du reflux, le choix entre réintervenion ou traitement médical, jamais urgent, doit être fondé sur une analyse en bénéfice/risque tenant compte au premier chef de la qualité de vie.
Les principales anomalies constatées sont :
- le démontage de la fundoplicature (23%),
- sa migration intrathoracique (28%) ou l’existence d’une hernie paraœsophagienne (6%) associées à une distension de l’orifice hiatal,
- plus rarement une sténose du hiatus (2%)
- l’existence d’un brachyœsophage qui très fréquemment rapportée dans la littérature nord américaine. Il est la séquelle d’un reflux ancien avec sclérose pariétale circonférentielle et longitudinale, qui ne permettrait pas la restitution sans tension d’un œsophage abdominal de longueur suffisante et donc la réalisation d’une fundoplicature efficace. Il ne peut être que suspecté sur le TOGD sauf si existe une sténose peptique [36].
Un cas particulier non détectable par les explorations morphologiques endoscopique et radiologique est la malfaçon technique réalisant une fundoplicature gastro-gastrique entrainant un twist de la région sous cardiale avec un tableau clinique associant dysphagie, satiété précoce, sensation de ballonnement à tort étiqueté Gas Bloat Syndrome. Seule la réintervention avec démontage complet de la fundoplicature permettra l’identification et la correction de cette malfaçon.
La réintervention par laparoscopie est faisable (même après une première intervention menée par laparotomie) avec un taux de conversion de 5 à 10%, un risque de plaie digestive de 10%, une morbidité post-opératoire de 15%, une durée opératoire et de séjour significativement plus longues qu’une intervention de première intention [37, 38]. Après libération des adhérences sur le lobe hépatique gauche et le hiatus, parfois particulièrement serrées, le démontage de la fundoplicature initiale doit être complet et en cas de hernie paraœsophagienne le sac péritonéal est totalement disséqué et réséqué. Les difficultés de la dissection expliquent les risques de plaie digestive, de blessure des troncs des pneumogastriques, d’ouverture de la plèvre gauche et de plaie splénique. Après reconnaissance de l’anatomie, éventuellement aidée par une fibroscopie per-opératoire pour s’assurer de la position du cardia notamment en cas de suspicion de brachyœsophage, le temps de réparation comporte une hiatoplastie par suture rétro-œsophagienne, et aussi antérolatérale gauche des piliers en cas de hiatus distendu, dont il faut s’assurer qu’elle n’est pas sténosante pour l’œsophage (Fig 7) et une fundoplicature que nous préférons partielle postérieure et souple pour diminuer le risque élevé de dysphagie post-opératoire, difficile à traiter dans cette situation. Il n’y a pas de consensus quant à l’utilisation dans ces réinterventions de matériel prothétique pour la réparation du hiatus, les matériaux non résorbables exposent au risque de sténose hiatale et de migration dans la lumière digestive, les bioprothèses actuellement utilisées sont inefficaces. En cas de brachyœsophage ne permettant pas la réintégration satisfaisante du cardia en position intra-abdominale sans tension, on peut recourir à l’intervention de Collis-Nissen dont les résultats fonctionnels sont moins bons que ceux d’une seconde fundoplicature, notamment pour la dysphagie ou à une diversion duodénale totale [39, 40].
Figure 7 : Myoraphie postérieure et antérogauche
Les résultats de ces réinterventions, avec une morbidité post-opératoire de 15% et une mortalité de 1%, sont considérés avec un recul de 3 à 5 ans comme satisfaisants pour 75 à 80% des opérés qui cependant ne sont asymptomatiques (sans signe de reflux, sans dysphagie) qu’une fois sur deux et avec une qualité de vie significativement moins bonne que pour une première fundoplicature, les meilleurs résultats concernent les patients réopérés pour récidive de reflux [41, 42, 43]. La difficulté de préserver les troncs des pneumogastriques en cas de réintervention explique la fréquence de la diarrhée post-opératoire évaluée à 15% dans cette situation [44]. Une troisième intervention sera nécessaire pour 5 à 15% des patients et dans ces situations particulières doit se discuter l’indication à une diversion duodénale totale. Exceptionnellement les conditions anatomiques locales peuvent obliger à une résection œsophagogastrique.
Pour la pratique on retiendra
Les principales causes d’échec des fundoplicatures sont la récidive de reflux qui doit être objectivée par pH-métrie et la dysphagie.
Les anomalies du hiatus et de la fundoplicature sont souvent associées et sont identifiables dans 80% des cas.
Pour une récidive de reflux authentifiée le choix entre traitement médical et seconde opération repose sur une évaluation individuelle en bénéfice/risque.
En cas de dysphagie il existe le plus souvent des anomalies morphologiques explicatives que seule une réintervention peut corriger. En cas d’explorations morphologiques normales le diagnostic de malfaçon technique avec valve gastro-gastrique, nécessitant une réintervention, doit être préféré au diagnostic de Gas Bloat Syndrome.
Une réintervention par laparoscopie avec reconstruction d’une fundoplicature partielle postérieure est techniquement faisable avec des résultats satisfaisants pour 75% des opérés dont la qualité de vie sera moins bonne qu’après une intervention de première intervention.
Chirurgie antireflux : pour quels patients ?
Le traitement de première intention du reflux est médical, par les IPP, et il n’y a pas d’indication à une fundoplicature chez un patient qui n’a pas été traité médicalement ou dont le traitement médical n’a pas été optimisé. Les patients adressés au chirurgien sont habituellement dans les situations suivantes :
- patients soulagés par les IPP mais au prix d’une escalade du traitement médical ou patients jeunes désirant cesser la prise d’IPP par crainte des effets secondaires d’un traitement médical prolongé.
- patients soulagés par les IPP du pyrosis mais gênés par les régurgitations avec un syndrome postural.
- patients dont le traitement par IPP a été optimisé mais conservant des symptômes digestifs souvent difficiles à étiqueter
- patients dont les symptômes extradigestifs isolés ou prédominants (ORL ou respiratoires) sont attribués à un reflux. Cette situation sera traitée au chapitre Cas particuliers.
La persistance des symptômes malgré un traitement médical optimisé doit rendre particulièrement prudent quant à l’indication opératoire.
Patients soulagés par les IPP
De multiples effets secondaires dose/dépendants des IPP au long cours sont répertoriés, avec une faible prévalence : troubles digestifs avec malabsorption de la vitamine B12, du Fer, du Magnésium, du Calcium avec risque d’ostéoporose et de fracture ; risque infectieux avec pneumopathie et diarrhée liée à Clostridium Dfficile ; interaction médicamenteuse avec les antiagrégants plaquettaires [45, 46, 47]. On ne peut pas retenir ces éléments pour préférer en bénéfice/risque une intervention chirurgicale à un traitement médical au long cours. Il n’existe pas non plus d’arguments médico-économiques pour prendre cette décision. Les études coût/efficacité, coût/utilité ou les études faisant appel à un modèle de Markof ne permettent pas au praticien de prendre une décision individuelle, elles proviennent de pays avec des systèmes de financement de la santé très différents du système français (Etats-Unis et Europe du Nord) et les résultats, contradictoires quant à la supériorité de l’un ou l’autre traitement, sont difficilement transposables.
Pour la comparaison des résultats entre traitement médical et fundoplicature chez des patients bien contrôlés par les IPP, nous disposons de 5 études randomisées, d’une métaanalyse de la Cochrane Database et d’une revue générale compilant 166 publications [18, 19, 48, 49, 50, 51, 52]. Deux de ces études randomisée sont particulières : dans l’une au bout d’un an de traitement médical le patient avait le choix d’opter pour le traitement chirurgical, dans l’autre les résultats des patients randomisés étaient aussi comparés avec ceux d’un groupe de patients ayant opté hors randomisation pour un traitement chirurgical. La fundoplicature utilisée dans ces études, dont pour certaines les résultats ont été publiés plusieurs fois au fur et à mesure du recul, était majoritairement une fundoplicature totale circulaire dont la technique n’a été standardisée que dans l’étude LOTUS. Pour des reculs de 12 mois à 12 ans le contrôle des symptômes liés à l’acidité est équivalent pour les deux traitements ou supérieur pour la chirurgie ; dans l’étude où les patients pouvaient secondairement opté pour le traitement chirurgical les résultats à 7 ans du traitement chirurgical sont meilleurs que dans le bras traitement médical prolongé ; dans l’étude randomisée coopérative anglaise où les résultats étaient aussi comparés à ceux des patients non randomisés ayant opté pour le traitement chirurgical les résultats du traitement dans les deux groupes chirurgicaux étaient meilleurs. Les évaluations par des scores de qualité de vie (PGWBI, SF-36) et des effets secondaires montraient au moins à court terme un avantage souvent significatif pour le traitement chirurgical. A long terme les effets secondaires de la chirurgie, particulièrement bien répertoriés dans l’étude LOTUS, peuvent contrebalancer les avantages de la chirurgie sur le contrôle des symptômes liés au reflux et l’étude anglaise concluait que ces effets secondaires pouvaient être pires que les symptômes liés au reflux persistants sous IPP. La métaanalyse concluait prudemment à la nécessité d’une analyse en bénéfice/risque notamment focalisée sur la qualité de vie pour chaque patient dûment informé de ces éléments. Il faut aussi garder à l’esprit le caractère non réversible d’une fundoplicature, la possible dégradation progressive de ses résultats avec le temps et l’évolution permanente des traitements médicaux et endoscopiques : Nothing is lost by waiting [53]. Enfin en dehors d’une intervention antireflux, la maladie reflux gastro-œsophagien n’engage pas le pronostic vital. La recommandation de l’American Gastroenterological Association Institute de poursuivre le traitement médical est de grade A avec fort niveau de preuve [54].
Un cas particulier est celui des patients soulagés de leur symptômes mais intolérants aux IPP pour lesquels l’intervention est recommandée (Grade A des recommandations de l’American Gastroenterological Association Institute).
Patients soulagés du pyrosis par les IPP mais régurgiteurs
Sous réserve de l’authentification préalable d’un reflux pathologique sur l’existence d’une œsophagite endoscopique ou d’une pH-métrie anormale, c’est probablement la meilleure indication à la réalisation d’une fundoplicature par laparoscopie si l’état général et les antécédents du patient le permettent. En cas de doute diagnostique une manométrie permet d’éliminer une achalasie. Pour ces patients dont la qualité de vie peut être gravement altérée par l’intensité du syndrome postural, avec le risque d’inhalation nocturne, l’expérience montre que la satisfaction post-opératoire est souvent excellente même si existent des effets secondaires. Il n’y a pas dans cette situation d’argument pour préférer une fundoplicature totale circulaire à une fundoplicature partielle postérieure. La recommandation de l’American Gastroenterological Association Institute pour la chirurgie antireflux est de grade B.
Patients restant symptomatiques malgré un traitement médical optimisé
Ces patients plus communément appelés résistants ou réfractaires au traitement médical ont souvent au moment de la consultation chirurgicale une longue histoire de reflux traité par plusieurs IPP. La multiplicité des consultations et des intervenants qui a jalonné ce parcours rend l’interprétation des symptômes allégués difficile tant ils sont devenus stéréotypés. Il n’est pas rare que les éléments permettant l’authentification d’un reflux pathologique et responsable des symptômes ne soient pas disponibles. Dans ce groupe de patients, des facteurs psychoémotionnels comme l’anxiété ou la dépression, ou l’effet Nocebo peuvent compliquer le recueil des données cliniques [55]. Ce diagnostic de résistance aux IPP ne peut être retenu qu’en cas de persistance des symptômes survenant 3 fois par semaine pendant 3 mois chez un patient à double dose d’IPP dont on vérifié la bonne prise, éventuellement associée à la prise d’alginates ou anti-H2 [56]. La suite de la prise en charge vise à sélectionner les patients possiblement éligibles à une intervention chirurgicale en faisant la preuve d’une part d’un reflux persistant et d’autre part de sa corrélation avec les symptômes [57].
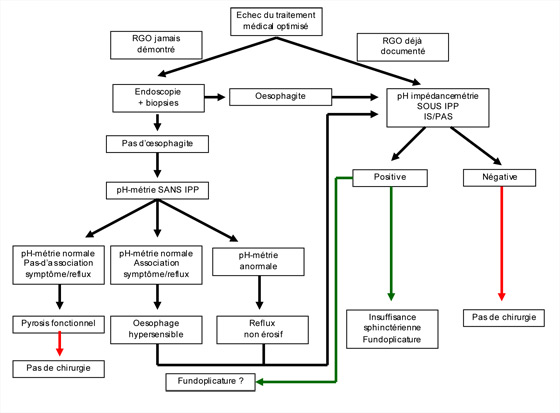
Chez des patients dont le reflux pathologique n’a jamais été documenté, l’endoscopie avec biopsies est le premier examen à réaliser. En l’absence d’œsophagite une ph-métrie sans IPP permettra de classer les patients :
- pyrosis fonctionnel (ph-métrie normale, pas de corrélation symptômes/reflux) ne relevant pas de la chirurgie,
- œsophage acido-sensible (ph-métrie normale, corrélation symptômes/reflux) et reflux non érosif (ph-métrie anormale), ces deux catégories pouvant relever de la chirurgie.
La pH-impédancemétrie sous IPP est proposée :
- en cas découverte d’une œsophagite, après élimination d’une autre cause (œsophagite infectieuse ou à éosinophiles),
- en cas d’œsophage acido-sensible et de reflux non érosif,
- aux patients dont le reflux a déjà été objectivé.
L’analyse des valeurs de l’index symptomatique de la probabilité d’association symptomatique, si elles sont respectivement supérieures à 50% et 95%, permettrait de sélectionner pour la chirurgie les patients ayant un reflux persistant lié à une insuffisance sphinctérienne, acide ou non acide, responsable des symptômes (Fig 8) Les résultats des fundoplicatures sont ici moins bons que chez les opérés avec des symptômes typiques et répondant au traitement par IPP. Pour les patients ayant un œsophage acido-sensible ou un reflux non érosif, l’intervention doit se discuter en bénéfice risque avec un traitement médical associant IPP et inhibiteur des relaxations transitoires du sphincter inférieur de l’œsophage (hors AMM) dont la tolérance clinique pose problème. L’efficacité de la chirurgie antireflux en cas d’œsophage hypersensible est suggérée dans quelques études à faible effectif mais non clairement démontrée.
Figure 8 : Algorithme décisionnel chez les patients symptomatiques sous IPP. D’après Sifrim D (57).
Pour la pratique on retiendra
Pour les patients efficacement traités par les IPP, sans intolérance, en bénéfice/risque il n’y a pas d’indication chirurgicale. Les risques décrits du traitement au long cours par IPP ne permettent pas de modifier cette recommandation actuellement.
La chirurgie est indiquée chez les patients sous IPP soulagés du pyrosis mais régurgiteurs.
Pour les patients qui restent symptomatiques sous IPP, après optimisation du traitement médical, une évaluation « step by step » permet de sélectionner pour la chirurgie les candidats chez qui persiste un reflux possiblement responsable des symptômes.
La valeur prédictive positive d’une pH-impédancemétrie sous IPP anormale pour un bon résultat d’une fundoplicature n’est pas clairement démontrée.
Cas particuliers
Obésité et reflux gastro-œsophagien
Les études épidémiologiques américaines, européennes et asiatiques montrent l’augmentation parallèle et concomitante des prévalences de l’obésité et du reflux. La surcharge pondérale et l’obésité sont probablement des facteurs de risque indépendants pour le reflux avec un risque relatif X 3 pour un IMC > 30 [58]. Il existe dans cette population une augmentation de la pression abdominale et du gradient gastro-œsophagien associées à une forte prévalence de la hernie hiatale, quasi constante pour un IMC > 35. A côté de ces facteurs mécaniques on note aussi une diminution du tonus du sphincter inférieur de l’œsophage (> 50% pour un IMC > 30) et des relaxations transitoires post prandiales plus fréquentes. Il existe aussi des facteurs métaboliques avec des modifications des secrétions de leptine et d’adiponectine par la masse grasse expliquant la liaison entre volume de graisse abdominale évalué par examen tomodensitométrique et risque relatif d’œsophagite. L’obésité augmente aussi le risque de complications du reflux : le risque relatif d’endobrachyœsophage et sa longueur sont corrélés au ratio taille/tour de hanche et il existe une synergie obésité/reflux pour la survenue d’un adénocarcinome avec un risque relatif X 16.5. Chez ces patients dont la prévalence de reflux symptomatique est > 50% pour un IMC > 35, la perte de poids est régulièrement associée à une amélioration clinique et permet une augmentation du taux de cicatrisation de l’œsophagite sous IPP [59].
Les résultats des fundoplicatures, qu’elles soient totale circulaire ou partielle postérieure, sont moins satisfaisants dans cette population avec des taux de récidive symptomatique > 25% dès un IMC > 30. Ces mauvais résultats peuvent s’expliquer par une moins bonne réalisation technique de la fundoplicature et la persistance des facteurs mécaniques et métaboliques favorisant le reflux. Chez les patients ayant un IMC > 35 et donc éligibles à une intervention de chirurgie bariatrique, le Gastric Bypass est plus efficace sur le reflux que la fundoplicature totale circulaire et procure une meilleure qualité de vie [60]. En cas de reflux, le Gastric Bypass parait préférable à l’anneau gastrique et à la sleeve gastrectomie [61]. Cette intervention est efficace pour la perte d’excès de poids et le montage supprime tout risque de reflux acide et biliopancréatique, l’existence d’une hernie hiatale ne complique pas sa réalisation technique et ne compromet pas son efficacité sur le traitement du reflux.
L’apparition ou la persistance de reflux après chirurgie bariatrique doit faire rechercher une malfaçon technique ou une complication : en cas d’anneau bascule de l’anneau, troubles moteurs ou distension de l’œsophage ; en cas de sleeve gastrectomie sténose médiogastrique ou hernie hiatale initialement méconnue ; en cas de Gastric Bypass poche gastrique de trop grand volume ou sténose de l’anastomose gastrojéjunale. Le traitement peut être endoscopique (dilatation d’une sténose) ou chirurgical (dépose de l’anneau et Gastric Bypass, transformation d’une sleeve gastrectomie en Gastric Bypass). Les Gastric Bypass de seconde intention après sleeve gastrectomie donne des résultats comparables à ceux faits de première intention.
Pour la pratique on retiendra
Il existe des facteurs mécaniques mais aussi métaboliques responsables du reflux chez l’obèse.
La réalisation d’une fundoplicature est plus difficile techniquement et les résultats sont moins bons pour un IMC > 35.
En cas de reflux, le Gastric Bypass doit être préféré à l’anneau ou à la sleeve gastrectomie.
La survenue d’un reflux après chirurgie bariatrique doit faire rechercher une complication de la procédure.
Manifestations extradigestives du reflux gastro-œsophagien
Le reflux gastro-oesophagien est incriminé dans la survenue de manifestations respiratoires, de symptômes ORL et de douleurs thoraciques. Dans la définition de Montréal une association n’est retenue que pour la toux, la laryngite, l’asthme et les érosions dentaires. Le reflux a aussi été mis en cause en cas de rejet aigu après transplantation pulmonaire. En cas de toux chronique, chez des patients non fumeurs avec cliché thoracique normal et ne prenant pas d’inhibiteur de l’enzyme de conversion de l’angiotensine, le reflux serait en cause dans 20% des cas. Cette toux ne s’accompagne pas habituellement de symptôme digestif évocateur de reflux (80%) et la majorité des endoscopies ne montre pas d’œsophagite. La pH-métrie n’est anormale que moins d’une fois sur deux par défaut de détection de reflux faiblement acide ou non acide ; l’analyse de l’indice de concordance symptomatique ne sera pas contributive si la fréquence des évènements est faible ou au contraire très élevée [62]. La laryngite se manifeste par de l’enrouement, de la toux, une fatigabilité de la voix, voire une dysphonie chronique. Les anomalies décrites en laryngoscopie sont peu spécifiques sauf les ulcérations postérieures. Elles dépendent de la technique de laryngoscopie et il existe une grande variabilité inter-observateur dans leur description. Dans l’asthme, si dans la majorité des cas il n’y a pas de symptôme digestif associé, la prévalence du reflux pathologique en pH-métrie est supérieure à 50%. Les douleurs thoraciques extracardiaques sont principalement liées au reflux gastro-oesophagien et lui sont rattachées après des explorations cardiaques normales et une manométrie éliminant un trouble moteur de l’œsophage en fait peu fréquent dans cette situation, d’autant que les signes digestifs typiques sont présents dans la grande majorité des cas [63].
Toutes ces manifestations symptomatiques ont en commun :
- sur le plan clinique, en dehors des douleurs extracardiaques, la rareté des manifestations typiques de reflux associées et l’étiologie probablement multifactorielle des manifestations ORL et respiratoires,
- l’insuffisance de la ph-métrie pour les relier à un reflux
- l’utilité discutée d’une pH impédancemétrie anormale pour prendre une éventuelle décision chirurgicale [64].
En pratique la recommandation est de traiter de façon empirique ces patients par IPP à double dose pendant au moins 12 à 16 semaines et de n’envisager une intervention antireflux, après élimination d’une cause locale, que chez les patients alors devenus asymptomatiques, surtout si les symptômes récidivent à l’arrêt des IPP [65]. La chirurgie serait d’autant plus efficace, y compris en qualité de vie, que ces manifestations extradigestives sont associées à des signes typiques de reflux [66]. Pour la laryngite l’efficacité de la fundoplicature totale circulaire est inférieure à 70% avec paradoxalement plus de 90% des opérés qui sont satisfaits [67]. Pour les malades asthmatiques une intervention antireflux n’apporterait qu’un bénéfice mineur sur les symptômes et la qualité de vie sans amélioration de la fonction pulmonaire ou de bénéfice pour le traitement médical spécifique.
Pour la pratique on retiendra
Pour l’American Gastroenterological Association Institute, la recommandation de la chirurgie antireflux dans ces situations est de grade C avec un niveau de preuve moyen.
La balance bénéfice/risque ne permettant pas de recommandation généralisée, la décision sera individualisée pour un patient clairement informé.
Reflux et endobrachyœsophage
L’existence d’un endobrachyœsophage ne modifie pas l’efficacité des fundoplicatures [68]. La fundoplicature n’a pas d’effet protecteur de la survenue d’un adénocarcinome [69]. L’existence d’un endobrachyoesophage ne modifie pas les indications de la chirurgie antireflux [70, 71]. L’indication chirurgicale pourrait se discuter chez des patients avec sous IPP une œsophagite persistante Los Angeles C ou D ou en cas d’apparition de lésion de dysplasie de bas grade malgré un traitement par IPP à double dose. Les résultats des fundoplicatures pour la régression macroscopique de l’endobrachyœsophage ou d’une dysplasie après fundoplicature sont contradictoires.
Pour la pratique on retiendra
La présence d’un endobrachyœsophage ne constitue pas une indication particulière de la chirurgie antireflux.
Conclusion
La fundoplicature partielle postérieure par laparoscopie apparaît comme la technique de choix pour la chirurgie antireflux de par ses résultats sur les symptômes liés au reflux et son peu d’effets secondaires. Les indications sont actuellement moins nombreuses et mieux codifiées, les meilleurs candidats à cette chirurgie étant les patients régurgiteurs sous IPP. Pour toutes les autres situations où l’évaluation a permis de sélectionner, parmi des patients symptomatiques sous traitement médical, ceux ayant un reflux persistant jugé probablement responsable des symptômes, la discussion doit se faire en bénéfice/risque individuellement. Les patients asymptomatiques sous IPP ne doivent pas être opérés.
Références bibliographiques
- Ayazi S, Tamhankar A, DeMeester SR, Zehetner J, Wu C, Lipham C, Hagen JA, DeMeester TR. The impact of gastric distension on the lower esophageal sphincter and its exposure to acid gastric juice. Ann Surg 2010 ; 252 : 57-62.
- Peters MJ, Mukhtar A, Yunus RM, Khan S, Pappalardo J, Memon B, Memon MA. Meta-analysis of randomized clinical trials comparing open and laparoscopic anti-reflux surgery. Am J Gastrenterol 2009 ; 104 : 1548-61.
- Salminen P, Hurme S, Ovaska J. Fifteen-year outcome of laparoscopic and open Nissen fundoplication : a randomized clinical trial. Ann Thorac Surg 2012 ; 93 : 228-33.
- Attwood SE, Lundell L, Ell C, Galmiche JP, Hatlebakk J, Fiocca R et al. World J Surg 2008 ; 32 : 995-8.
- Neufeld M, Graham A. Levels of evidence available for techniques in antireflux surgery. Dis esophagus 2007; 20 : 161-7.
- Gutschow CA, Hölscher AH. Surgical treatment of gastroesophageal reflux disease. Langenbecks Arch Surg 2012 ; Apr 12.
- Niebisch S, Peters JH. Update on fundoplication for the treatment of GERD. Curr Gastroenterol Rep 2012 ; 14 : 189- 196.
- Mariette C, Pessaux P. Ambulatory laparoscopic fundoplication for gastroesophageal reflux disease : a systematic review. Surg Endosc 2011 ; 25 : 2859-64.
- Niebish S, Fleming FJ, Galey KM, Wilshire CL, Jones CE, Litle VR et al. Perioperative risk of laparoscopic fundoplication : safer than previously reported-analysis of the American College of Surgeons National Surgical Quality Improvement Program 2005 to 2009. J Am Coll Surg 2012 ; 215 : 61-8.
- Wang YR, Dempsey DT, Richter DE. Trends and perioperative outcomes of inpatient antireflux surgery in the United States, 1993-2006. Dis Esophagus 2011 ; 24 : 215-23.
- Varban OA, Mc Coy TP, Westcott C. A comparison of preoperative comorbidities and postoperative outcomes among patients undergoing laparoscopic nissen fundoplication at high- and low-volume centers. J gastrointest Surg 2011 ; 15 : 1121-7.
- Makris KI, Cassera MA, Kastenmeier AS, Dust CM, Swanström LL. Postoperative dysphagia is not predictive of long-term failure after laparoscopic fundoplication. Surg Endosc 2012 ; 26 : 451-7.
- Sciaudone G, Perniceni T, Chiche R, Levard H, Gayet B. Immediate postoperative complications after a laparoscopic patrial posterior fundoplication. Early laparoscopic reoperation. Ann Chir 2000 ; 125 : 838-43.
- Pessaux P, Arnaud JP, Delattre JF, Meyer C, Baulieux J, Mosnier H. Laproscopic antireflux surgery. Arch Surg 2005 ; 140 : 946-51.
- Kelly JJ, Watson DI, Chin KF, Devitt PG, Game PA, Jamieson GG. Laparoscopic Nissen fundoplication : clinical outcome at 10 years. J Am Coll Surg 2007 ; 205 : 570-5.
- Dallemagne B, Weers J, Markiewicz S, Dewandre JM, Wahlen C, Monami B et al. Clinical results of laparoscopic fundoplication at ten years after surgery. Surg Endosc 2006 ; 20 : 159-65.
- Mardani J, Lundell L, Engström C. Total or posterior partial fundoplication in the treatment of GERD : results of a randomized trial after 2 decades of follow up. Ann Surg 2011 ; 253 : 875-8.
- Galmiche JP, Hattlebakk J, Atwood S, Ell C, Fiocca R, Eklund S et al; laparoscopic antireflux surgery vs esomeprazole treatment for chronic GERD : the LOTUS randomized clinical trial. JAMA 2011 ; 305 : 1969-77.
- Anvari M, Allen C, Marshall J, Armstrong D, Goeree R, Ungar W et al. A randomized controlled trial of laparoscopic Nissen fundoplication versus proton pomp inhibitors for the treatment of patients with chronic gastroesophageal reflux disease : 3-year outcomes. Surg Endosc 2011 ; 25 : 2547-54.
- Broeders JA, Bredenoord AJ, Hazebroek EJ, Broeders IA, Gooszen HG, Smout AJ. Reflux and belching after 270 degree versus 360 degree laparoscopic posterior fundoplication. Ann Surg 2012 ; 255 : 59-65.
- Ramos RF, Lustosa SA, Almeida CA, Silva CP, Matos D. Surgical treatment of gastroesophageal reflux disease : total or partial fundoplication ? Systematic review and meta-analysis. Arq Gastroenterol 2011 ; 48 : 252-60.
- Varin O, Veistra B, De Sutter S, Ceelen W. Total vs partial fundoplication in the treatment of gastroesophageal reflux dusease : a meta-analysis. Arch Surg 2009 ; 144 : 273-8.
- Broeders JA, Mauritz FA, Ahmed AU, Draaisma WA, Ruurda JP, Gooszen HG et al. Systematic review and meta-analysis of laparoscopic Nissen (posterior total) versus Toupet (posterior partial) fundoplication for gastroesophageal reflux disease. Br J Surg 2010 ; 97 : 1318-30.
- Tan G, Yang Z, Wang Z. Meta-analysis of laparoscopic total (Nissen) versus posterior (Toupet) fundoplication for gastroesophageal reflux disease based on randomized clinical trials. ANZ J Surg 2011 ; 81 : 246-52.
- Nijjars RS, Watson DI, Jamieson GG, Archer S, Bessel JR, Booth M et al.Five year follow up of multicenter, double-blind randomized clinical trial of laparoscopic Nissen versus anterior 90 degrees partial fundoplication. Arch Surg 2010 ; 145 : 552-7.
- Broeders JA, Roks DJ, Jamieson GG, Devitt PG, Baigrie RJ, Watson DI. Five year outcome after laparoscopic anterior partial fundoplication versus Nissen fundoplication : four randomized trials. Ann Surg 2012 ; 255 ; 637-42.
- Gee DW, Andreoli MT, Rattner DW. Measuring the effectiveness of laparoscopic antireflux : long-term results. Arch Surg 2010 ; 143 : 482-7.
- Teixeira JP, Mosquera V, Flores A. Long-term outcomes of quality of life after laparoscopic Nissen fundoplication. Hepatogastrenterology 2009 ; 56 : 80-4.
- Tosato F, marano S, mattacchione S, Luongo B, Mingarelli V, Campagna G. Quality iof life after Nissen-Rossetti fundoplication. Surg Laparosc Endosc Percutan Tech 2012 ; 22 : 205-9.
- Slim K, Bousquet J, Kwiatkowski F, Lescure G, Pezet D, Chipponi J. Quality of life before and after laparoscopic fundoplicayion. Am J Surg 2000 ; 180 : 41-5.
- Borie F, Glaise A, pianta E, Veyrac M, Millat B. Long-term quality-of-life assessment of gastrointestinal symptoms before and after laparoscopic Nissen fundoplication. Gastroenterol Clin Biol 2010 ; 34 : 397-402.
- Koch OO, Kaindlstorfer A, Antoniou SA, Asche KU, Granderath FA, Pointer R. Laparoscopic Nissen versus Toupet fundoplication : objective and subjective results of a prospective randomized trial. Surg Endosc 2012 ; 26 : 413-22.
- Lord RV, Kaminski AK, Oberg S, Bowrey DJ, Hagen JA, DeMeester SR et al. Absence of gastroesophageal reflux disease in a majority of patients taking acid suppression medications after Nissen fundoplication. J gastrointest Surg 2002 ; 6 : 3-10.
- Velanovich V. Medication usage and additional esophageal procedures after antireflux surgery. Surg Laparosc Endosc Percutan Tech 2003 ; 3 : 161-4.
- Contini S, Scarpignato C. Evaluation of clinical outcome after laparoscopic antireflux surgery in clinical practice : still a controversial issue. Minim Invasive Surg 2011 ; 2011 : 725472.
- Furnée EJ, Draaisma WA, Broeders IA, Gooszen HG. Surgical reintervention after failed antireflux surgery : a systematic review. J Gastrointest Surg 2009 ; 13 : 1539-49.
- .Van Beek DB, Auyang ED, Soper NJ. A comprehensive review of laparoscopic redo fundoplication Surg Endosc 2011 ; 25 : 706-12.
- Musunuru S, Gould JC. Periopertive outcomes of surgical procedure for symptomatic fundoplication failure : a retrospective case-control study. Surg Endosc 2012 ; 26 : 838-42.
- Khajanchee YS, O’Rourke R, Cassera M, Gatta P, Hansen P, Swanström LL. Laparoscopic réintervention for failed antireflux surgery. Arch Surg 2007 ; 142 : 785-92.
- Légner A, Tsuboi K, Batha L, Lee T, Morrow LE, Mittal SK. Reoperative antireflux surgery for dysphagia. Surg Endosc 2011 ; 25 : 1160-7.
- Lamb PJ, Myers JC, Jamieson GG, Thompson SK, Devitt PG, Watson DI. Long-term outcomes of revisional surgery following laparoscopic fundoplication. Br J Surg 2009 ; 96 : 391-7.
- Symons NR, Purkayastha S, Dillemans B, Athanasiou T, Hanna GB, Darzi et al. Laparoscopic revision of failed antireflux surgery : a systematic review. Am J Surg 2011 ; 202 : 336-43
- Vignal JC, Luc G, Wagner T, Cunha AS, Coolet D. Re-operation for failed gastro-esophageal fundoplication. What results to expect ? J Visc surg 2012 ; 149 : e61-5.
- Byrne JB, Smithers BM, Nathanson LK, martin I, Ong HS, Gotley DC. Symptomatic and functional outcome after laparoscopic reoperation for failed antireflux surgery.
- Ito T, Jensen RT. Association of long-term proton pump inhibitor therapy wiyh bon fractures and effects on absorption of calcium, vitamin B12, iron and magnesium. Curr Gastroenterol Rep 2010 ; 12 : 448-57.
- Sheen E, Triadafilopoulos G. Adverse effect of long-term proton pump inhibitot therapy. Dig Dis Sci 2011 ; 56 : 931-50.
- von Rahden BH, Scheurlen M, Filser J, Stein HJ, Germer CT. Newly recognized side-effects of proton pump inhibitors. Arguments in favour of fundoplication for GERD ? Chirug 2012 ; 83 : 38-44.
- Metha S, Bennett J, Mahon D, Rhodes M. Prospective trial of laparoscopic Nissen fundoplication versus proton pump inhibitor therapy for gastro-esophageal reflux disease : seven-year follow-up. J Gastrointest surg 2006 ; 10 : 1312-7.
- Lundell L, Mietinen P, Myrvold HE, Hatlebakk JG, Wallin L, Engström C et al. Comparison of outcomes twelve years after antireflux surgery or omeprazole maintenance therapy for reflux esophagitis. Clin gastroenterol hepatol 2009 ; 7 : 1292-8.
- Grant AM, Wileman SM, Ramsay CR, Mowat NA, Krukowski Z, Heading RC et al. Minimal invasive surgery compared with medical management for chronic gastro-esophageal reflux disease : UK collaborative randomised trial. BMJ 2008 ; 337 : a 2664.
- Wileman SM, Mc Cann S, Grant AM, Krukowski ZH, Bruce J. Cochrane Database Syst Rev 2010 ; 17 : CD003243.
- Ip S, Chung M, Moorthy D, Yu WW, Lee J, Chan JA et al. Comparative effectiveness of management strategies for gastroesophageal reflux disease : update. Comparative effectiveness reviews, N° 29. Agency for Healthcare Research and Quality, Sepember 2011, Report N° : 11-EHC049-EF.
- Kahrilas PJ. Management of GERD : medical versus surgical. Semin Gastrointest Dis 2001 ; 2 :3-15.
- Kahrilas PJ, Shaheen N, Vaezi MF. American Gastroenterological Association Institute technical review on the management of gastroesophageal reflux disease. Gastroenterology 2008 ; 1392-1413.
- Velanovich V. Nonsurgical factors affecting symptomatic outcomes of antireflux surgery. Dis esophagus 2006 ; 19 : 1-4.
- Hershcovici T, Fass R. Step-by-step management of refractory gastroesophageal reflux disease. Dis esophagus 2012 ; Feb 6, DOI : 10.1111/j.1442-2050.2011
- Sfirim D, Zerbib F. Diagnosis and management of patients with reflux symptoms refractory to proton pump inhibitor. GUT 2012 ; 61 :1340-1354.
- Jacobson BC, somers SC, Fuchs CS, Kelly CP, Camargo CA Jr. Body-mass index and symptoms of gastroesophageal reflux in women. N Engl J Med 2006 ; 354 : 2340-8.
- Sheu BS, Chang WL, Cheng HC, Kao AW, LU CC. Body mass index can determine the healing of reflux esophagitis Los Angeles Grades C and D by esomeprazole. Am J Gastroenterol 2008 ; 103 : 2209-14.
- De GrootNL, Burgerhart JS, Van De Meeberg PC, de Vries DR, Smout AJ, Siersema PD. Systematic review : the effects of conservative and surgical treatment for obesity on gastroesophageal reflux disease. Aliment Pharmacol Ther 2009 ; 30 : 1091-102.
- Reavis K. Management of the obese patient with gastroesophageal reflux disease. Thorac Surg Clin 2011 ; 21 : 489-98.
- Ducrotté P, manifestations extradigestives du reflux gastro-œsophagien chez l’adulte. Rev Prat 2008 ; 58 : 1421-28.
- Yuksel ES, Vaezi MF. Extraesophageal manifestations of gastroesophageal reflux disease ; cough, asthma, laryngitis, chet pain. Swiss Med Wkly 2012 ; 142 : w13544.
- Tutuian R, Mainie I, Agrawal A, Adams D, Castell DO. Nonacid reflux in patients with chronic cough on acid-suppressive therapy. Chest 2006 ; 130 : 386-91.
- Poelmans J, Tack J. Extraesophageal manifestations of gastro-oesophageal reflux. GUT 2005 ; 54 : 1492-9.
- Farrell TM, Richardson WS, Trus TL, Smith CD, Hunter JG. Response of atypical symptoms of gastro-oesophageal reflux to antireflux surgery. Br J Surg 2001 ; 88 : 1649-52.
- Salminen P, Karvonen J, Ovaska J. Long-term outcomes after laparoscopic Nissen fundoplication for reflux laryngitis. Dig Surg 2010 ; 27 : 509-14.
- Attwood SE, Lundell L, Hatlebakk JG, Eklund S, Junghard O, Galmiche JP et al. Medical or surgical management of GERD patients with Barrett’s esophagus : the LOTUS trial 3-year experience. J Gastrointest Surg 2008 ; 12 : 1646-55.
- Corey KF, Schmitz SM, Shaheen N. Does a surgical antireflux procedure decrease the incidence of esophageal carcinoma in Barrett’s esophagus ? A meta-analysis. Am J Gastroenterol 2003 ; 98 : 2390-4.
- Robaszkiewicz M, Coron E. Traitement de l’endobrachyoesophage. Hépato gastro 2011 ; 18 : 76-87. doi : 10.1684/hpg.2010.0544.
- Bulsiewicz WJ. Antireflux surgery in the proton pump inhibitor era. Cleveland Clinic Journal of Medicine 2012 ; 79 : 273-81.
Les Points forts
- La chirurgie antireflux n’est jamais indiquée comme traitement de première intention.
- La fundoplicature partielle postérieure réalisée par laparoscopie, avec une très faible morbi-mortalité, est efficace à moyen et long termes sur les symptômes liés au reflux. Elle améliore significativement la qualité de vie des opérés et donne moins d’effets secondaires digestifs que la fundoplicature totale circulaire. Une réintervention sera nécessaire chez 7 à 10 % des opérés.
- En bénéfice/risque il n’y a pas d’indication chirurgicale pour un patient asymptomatique sous IPP. Le patient régurgiteur sous IPP est une bonne indication à la chirurgie antireflux.
- Pour les patients symptomatiques sous IPP, après optimisation du traitement médical, une évaluation « step by step » s’appuyant sur la pH impédancemétrie permettra de sélectionner des patients éligibles à la chirurgie. La discussion doit se faire en bénéfice/risque avec un patient informé des effets secondaires de la fundoplicature.
- Pour les patients obèses avec un IMC > 35 ayant un reflux, les résultats de la fundoplicature sont moins bons et le Gastric Bypass est l’intervention bariatrique à privilégier.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION