Traitement par voie basse des lésions villeuses du rectum – Traitement endoscopique
Objectifs pédagogiques
- Savoir identifier les lésions villeuses rectales accessibles à un traitement endoscopique.
- Connaître les aspects endoscopiques, les limites de l’histologie et le rôle de l’échoendoscopie.
- Savoir choisir la procédure d’exérèse endoscopique.
- Savoir évaluer le caractère complet de l’exérèse et les modalités de surveillance.
Généralités
La résection muqueuse par voie endoscopique est le traitement de référence des lésions superficielles du tractus digestif sans risque ganglionnaire (1), les lésions villeuses ou laterally spreading tumors (LST) sont des lésions adénomateuses colorectales avec une extension en surface de plus de 2 cm qui oblige une réflexion particulière quant au choix de la résection et quant à la nécessité d’une résection en monobloc. Leur localisation rectale, sous péritonéale, entraîne une accessibilité particulièrement aisée, non seulement aux endoscopistes mais également aux chirurgiens avec un plus faible risque en cas d’effraction de la musculeuse, ce qui accroit les possibilités thérapeutiques.
Dans cette mise au point nous ne parlerons que des traitements endoscopiques, avec l’émergence de la dissection sous muqueuse, qui permet une résection de type chirurgicale visant le R0 et qui vient compléter les différentes méthodes de mucosectomie.
Les différents traitements endoscopiques (avantages et inconvénients)
La mucosectomie
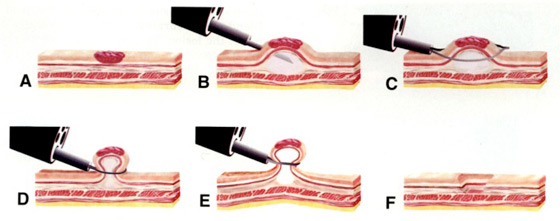
C’est la méthode la plus utilisée, car la plus ancienne et la plus accessible de par sa facilité d’apprentissage ; elle consiste à réaliser une injection sous muqueuse pour créer un espace de clivage entre la lésion et le plan musculaire puis d’utiliser une anse diathermique pour réaliser la préhension de la lésion puis la résection par électrocoagulation (le plus souvent avec un courant d’endocoup) (figure 1). L’objectif de cette méthode est de réaliser un résection en bloc, mais sur des lésions de plus de 2 cm de diamètre c’est quasiment impossible et la résection se réalise alors en plusieurs fragments (piecemeal) (2) . Dans ce cas, il faut être très organisé et s’attacher à réaliser un résection de proche en proche sans laisser de reliquat adénomateux en pont entre les résections et sur les berges (Photos 1 et 2).
Figure 1 : technique de la mucosectomie
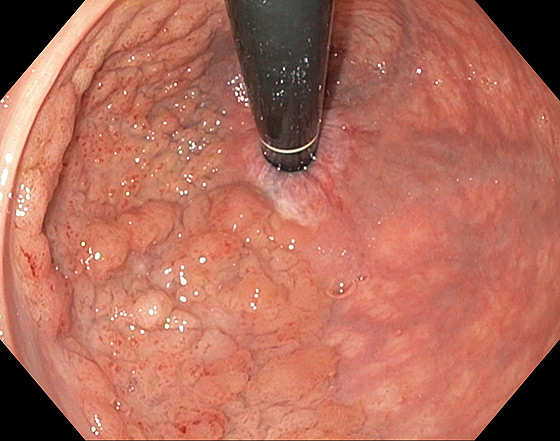
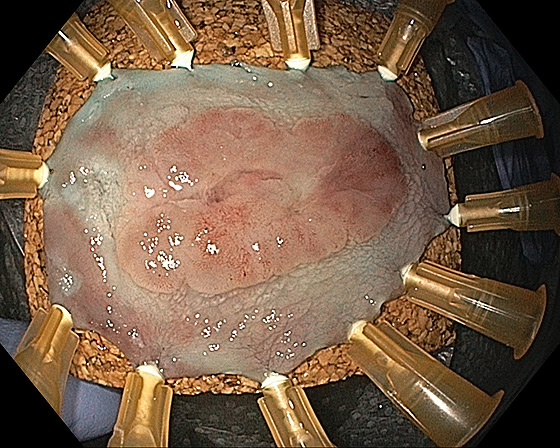
Photo 1 : LST granulaire homogène du bas rectum, pit pattern IV : lésion non suspecte de dégénérescence traitable par mucosectomie
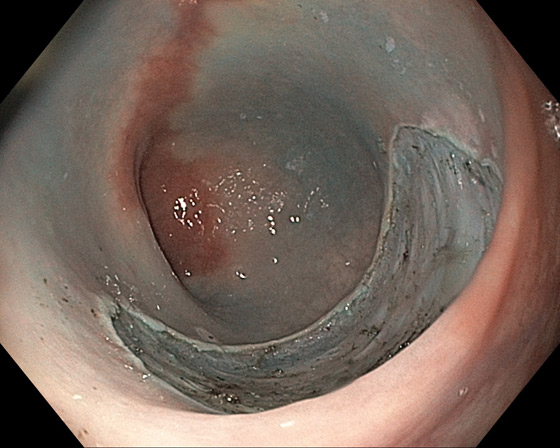
Photo 2 : site après mucosectomie en fragments
Les avantages
La simplicité d’utilisation et d’apprentissage et une efficacité démontrée à 98% de guérison pour des LST rectales après une à deux séances (2) , le tout pour une morbidité très faible de 3,8% vs 13% en cas de TEM (transanal endoscopic microsurgery) (p<0,001) (3).
Dans cette localisation, les saignements immédiats représentent 8% des cas (2) mais ne sont pas à considérer comme des complications car ils sont toujours traitables endoscopiquement et ne nécessitent jamais de transfusion (2) .
Les inconvénients
Il n’y en a qu’un seul, dû à l’absence de résection en bloc R0 ; c’est le risque de récidive précoce (3 mois) qui dans les LST rectales est de 8% à 11,5% (2; 3) . Mais qui sont le plus souvent traitables endoscopiquement, si bien que le risque de récidive tardive (>1an) après plusieurs séances est de 1,5%, ce qui est légèrement inférieur, mais de façon non significative, aux 3% de la TEM en une seule séance (3).
La dissection sous muqueuse ou ESD (endoscopic submucosal dissection)
Il s’agit d’une méthode plus récente créée au Japon initialement pour traiter les cancers superficiels gastriques, et qui s’est rapidement étendue aux autres localisations du tractus digestif, dont le rectum. Elle consiste également à réaliser une injection sous muqueuse pour créer un espace de clivage entre la lésion et le plan musculaire puis, à la place d’une résection à l’anse, on réalise une incision circonférentielle de la muqueuse autour de la lésion en respectant des marges de sécurité d’au moins 1 à 2 mm, et une dissection sous muqueuse à proprement parler pour séparer la lésion du plan profond, le tout en utilisant un ou plusieurs couteaux d’électrocoagulation (figure 2 et photos 3, 4 et 5).
Figure 2 : technique de la dissection sous muqueuse
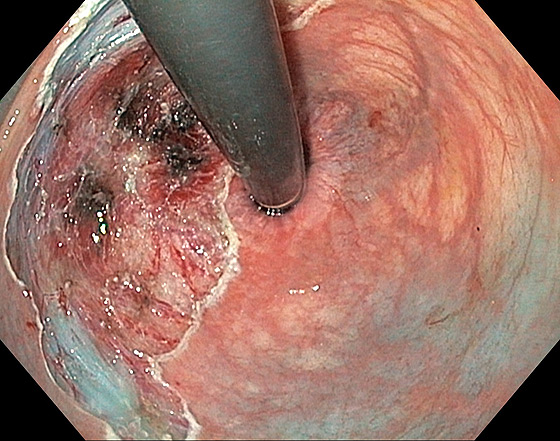
Photo 4 : site après dissection sous muqueuse
Photo 5 : lésion réséquée étalée sur plaque de liège avec marges latérales satisfaisantes
Les avantages
Il s’agit de l’unique technique endoscopique qui permette une résection en bloc visant le R0 pour des lésions superficielles de plus de 2 cm.
Son efficacité est proche de 100% en terme de guérison en cas de résection R0 avec des critère histologiques satisfaisants (cf. surveillance) puisque dans une revue de la littérature de 13 séries regroupant 1397 cas d’ESD colorectales R0, seul un cas de récidive a été constaté soit 0,07% (4), cette efficacité étant comparable à la TEM pour les mêmes critères histologiques mais avec une durée d’hospitalisation significativement inférieure avec respectivement 3,6 jours vs 6,6 jours (5), et également la possibilité de la réaliser sans anesthésie générale (5).
La survie spécifique sans récidive est de 100% à 3 et 5 ans (6) , ce qui n’est pas étonnant compte tenu du bon pronostic de ces lésions superficielles.
Les inconvénients
L’inconvénient principal est l’apprentissage long et difficile de cette technique qui la rend peu accessible actuellement en Europe, et donc réservée à des centres experts. En effet, il est indispensable d’avoir un formation sur modèle animal avec au moins 30 dissections avant de passer à l’homme (7). Au début, il sera préférable de débuter dans l’antre gastrique puis progressivement commencer à traiter des lésions du fundus puis du rectum (7). Selon les experts japonais, une expérience d’au moins 50 cas est nécessaire pour se considérer comme autonome (8) et a fortiori avant de débuter dans le côlon et l’œsophage (7). Et il faut ensuite garder un niveau d’activité annuel évalué à un minimum de 10 à 20 ESD (7).
Une étude allemande montre que malgré une expérience de plus de 100 ESD dans d’autres organes, il est nécessaire de réaliser 25 ESD rectales avant d’avoir des résultats satisfaisants comparables aux études asiatiques en terme de qualité de résection (soit >90 % de résection en bloc et >80% R0) et encore 25 autres pour améliorer sa rapidité (9).
Un autre inconvénient est la durée du geste qui est supérieure à une simple mucosectomie mais qui reste significativement inférieure pour des lésions comparables à la TEM avec respectivement 84 min (SD 51,2) vs 116,4 min (SD 58,5) (5). A l’heure actuelle il existe aussi un problème de surcoût de la technique comparé à une cotation de l’acte qui est insuffisante (pour exemple au japon une ESD correspond en valeur à 3 mucosectomies).
Les complications sont également plus fréquentes que pour la mucosectomie, mais sont comparables à celle de la TEM (5) et inférieures à la chirurgie laparoscopique (10). Elles sont dominées par les perforations avec un taux de 7,9% dans une étude allemande (9) mais bien sûr ce taux varie avec l’expérience puisse que dans une large étude multicentrique japonaise d’ESD colorectales il oscille entre 11,8% dans les centres avec une expérience inférieure à 50 cas par an, et 4,1% dans les centres à plus de 100 cas /an pour des ESD colorectales (11) . Elles sont dans la grande majorité des cas traitables endoscopiquement par la mise en place de clips et la localisation sous péritonéale les rend relativement anodines en terme de conséquence clinique (9; 11) . Les facteurs de risques exposant aux perforations sont la taille et la présence de fibrose sous muqueuse (12; 13) .
Quel traitement choisir pour quelle lésion ?
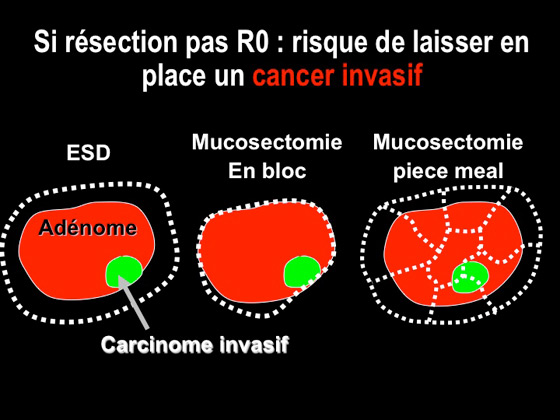
Une fois que l’on à détecté une LST rectale en coloscopie, il faut se poser la question de l’absolue nécessité d’une résection R0 car, si pour une lésion non dégénérée, on peut tolérer un risque de récidive précoce qui sera le plus souvent traitable par une seconde séance de mucosectomie, lorsqu’il s’agit d’une lésion dégénérée, ce risque n’est pas acceptable et il faudra préférer un résection R0 qui endoscopiquement ne peut être que par ESD si la lésion fait plus de 2cm (figure 3) (14) .
Figure 3 : comparaison schématique des différentes techniques de résection endoscopique
En pratique, il est rare que les biopsies réalisées éventuellement au préalable confirment le caractère dégénéré en cas de lésion superficielle, et il est même préférable de ne pas en réaliser avant une résection pour éviter la création de points de fibrose qui risqueront de rendre plus difficile la résection secondaire si toutefois elle sont pratiquées, il faut les cibler sur les zones les plus épaisses (12; 13) .
Il est cependant capital de réaliser un bilan systématique de caractérisation de la lésion pour prédire au plus juste la nature histologique et en cas de critère de dégénérescence de réaliser un bilan d’extension adapté.
Le bilan avant toute résection
A. La caractérisation endoscopique :
L’objectif de ce bilan est de déterminer le pronostic histologique avec le risque de dégénérescence et le risque ganglionnaire qui est corrélé à l’invasion en profondeur (14; 15) .
- La classification de PARIS et des LST :
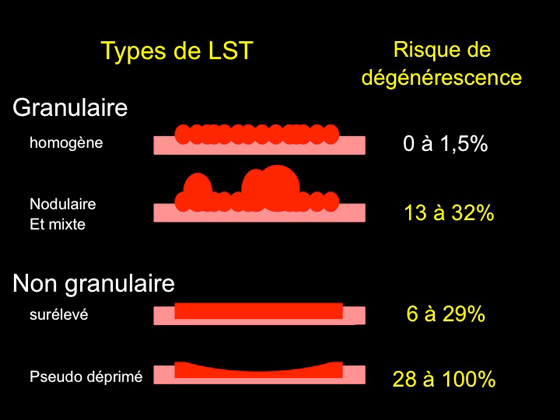
Elle se détermine selon l’aspect en relief de la lésion adénomateuse superficielle et est directement corrélée au risque de dégénérescence (figure 4 et 5) (15-18) .
Figure 4 : classification de Paris et risque de dégénérescence
Figure 5 : classification des LST et risque de dégénérescence
- le Pit pattern (Classification de KUDO) :
Initialement décrite avec l’analyse du pit pattern après coloration et zoom, elle est également déterminable avec les endoscopes haute résolution avec ou sans coloration virtuelle (figure 6) (14-16) .
Figure 6 : pit pattern
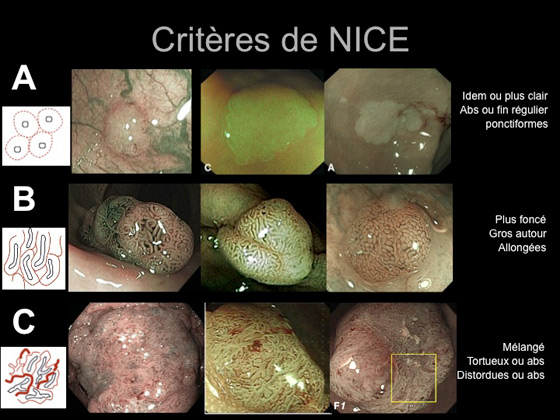
- La classification de NICE :
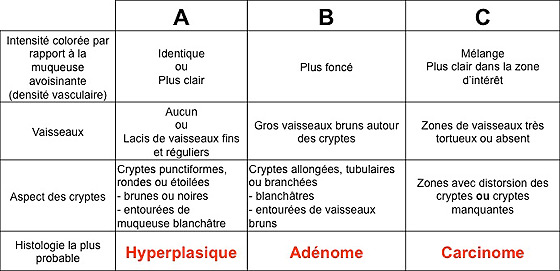
Il s’agit d’une classification plus récente qui introduit en plus la notion de vascular pattern en étude NBI (Narrow Band Imaging) Olympus© Tokyo Japon (tableau 1 et figure 7), et elle actuellement en cours de validation (19).
Tableau 1 : critères de NICE
Figure 7 : critères de NICE illustrés
B. L’échoendoscopie
Toute lésion comportant un critère de dégénérescence doit bénéficier d’une échoendoscopie car, si les limites latérale de la lésion sont évidentes à déterminer avec l’aide des endoscopes haute résolution si besoin en s’aidant d’une coloration à l’indigo carmin 0,2 à 0,4% ou d’une coloration virtuelle, il est indispensable de confirmer le caractère superficiel de la lésion avec l’absence d’envahissement en profondeur de la musculeuse et l’absence d’adénopathie, pour ne pas se lancer dans une résection qui peut être à risque et qui n’aura surtout aucun intérêt carcinologique en cas d’extension trop importante.
Seules les lésions uT1N0 pourront bénéficier d’une résection endoscopique.
L’échoendoscopie standard (5 à 12 MHz) au tube souple est la technique de référence dans cette indication ; elle permettra également l’exploration en amont de la charnière recto-sigmoïdienne. La sensibilité et spécificité sont respectivement de 97 et 96% pour les lésions limitées à la muqueuse et de 87,8 et 98,3% pour des lésions limitées à la sous muqueuse (20; 21) . La valeur prédictive positive pour différencier une lésion T1 d’une lésion T2/T3 est de 93,3% (22). L’utilisation de minisondes à haute fréquence (15 à 20MHz) peut améliorer la performance globale pour le diagnostic des lésions T1sm1, sm2 et sm3 avec respectivement 100, 92 et 93% (23) , mais très peu d’équipes l’utilisent en pratique courante et, de plus, elles ne permettent pas une bonne exploration à la recherche d’adénopathie du fait de leur faible profondeur de champ et elles sont également difficiles à utiliser en cas de volumineuses lésions végétantes.
Stratégie thérapeutique proposée
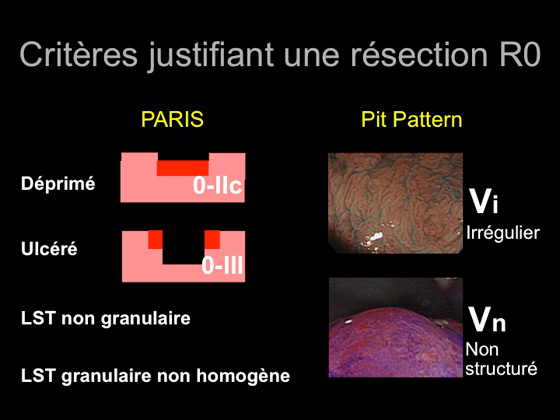
En somme, en cas de lésion déprimée, de LST NG ou G non homogène, d’un pit pattern à V et/ou un stade 3 de la classification de NICE, le risque de dégénérescence est significatif. L’échoendoscopie est alors indispensable pour confirmer le caractère superficiel et, enfin, la résection se doit d’être en bloc en visant le R0 pour éviter le risque de récidive cancéreuse (figure 8).
Figure 8 : critères endoscopiques macroscopiques de dégénérescence
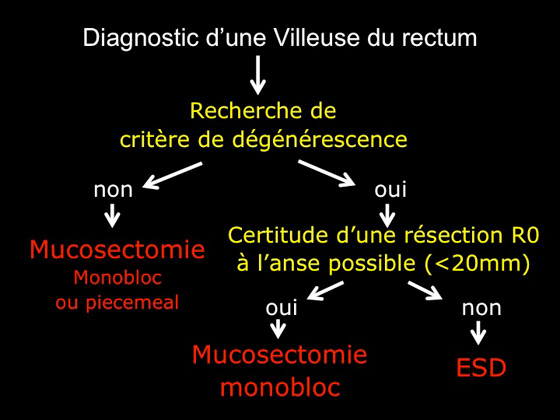
En suivant cette ligne de conduite, on peut proposer l’algorithme décisionnel suivant (figure 9).
Figure 9 : algorithme décisionnel du choix du traitement endoscopique
Quelle surveillance ?
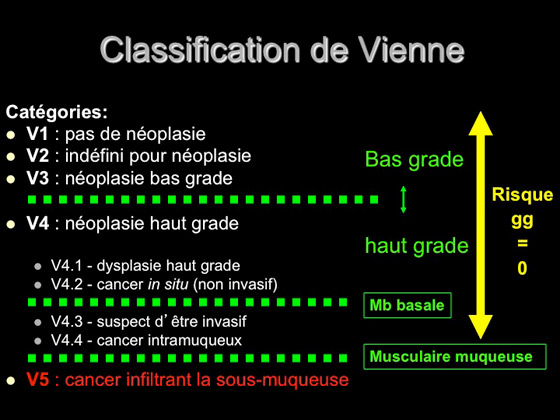
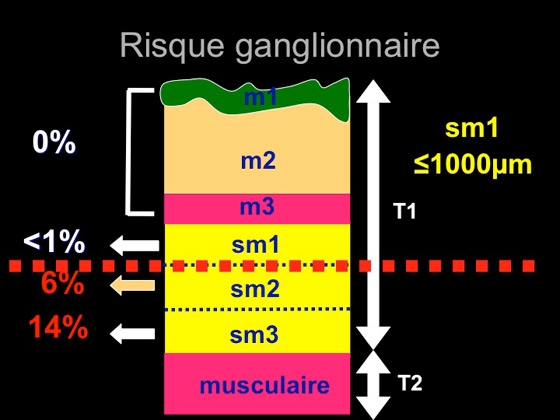
La décision définitive de valider la résection endoscopique comme suffisante ou de choisir une prise en charge chirurgicale complémentaire avec curage ganglionnaire se fait en fonction du résultat de l’analyse histologique finale, en utilisant la classification de Vienne (figure 10) (24) et en déterminant le risque ganglionnaire réel en cas de lésion dégénérée, qui est proportionnel à l’invasion en profondeur (figure 11) (14; 15; 25).
Figure 10 : classification de Vienne
Figure 11 : risque ganglionnaire en fonction de l’invasion en profondeur
Cette décision doit être prise dans le cadre d’une réunion pluridisciplinaire de cancérologie dès qu’une dégénérescence existe.
En cas de lésion dégénérée, le traitement endoscopique n’est jugé suffisant que si toutes les conditions suivantes sont réunies (14) :
- Résection complète R0 prouvée histologiquement (avec marges latérales et profondes).
- Lésion bien différenciée.
- Absence d’embol lymphatique ou vasculaire.
- Un envahissement en profondeur qui ne dépasse pas le premier tiers de la sous-muqueuse (soit < 1000 micromètres au delà de la musculaire muqueuse)
Puis la détermination du rythme de la surveillance se fait en suivant les recommandations habituelles après résection d’adénome colique édité par l’ANAES en 2004 :
Adénomes de bas grade (V3) ou adénomes avancés (>1cm ou contingent villeux ou dysplasie de haut grade (V4.1) ou cancer in situ (V4.2)) :
- Exérèse non R0 : coloscopie à 3 mois
- Exérèse complète R0 :
- si adénome avancé (V4.1 et V4.2) ou ≥3 adénomes ou ATCD familial de CCR (au premier degré) : colo à 3, 8, 13 et 23 ans tant que la coloscopie est normale
- si adénome en dysplasie de bas grade V3 et <3 adénomes et sans ATCD familial au premier degré : colo à 5,10 et 20 ans tant que la coloscopie est normale.
Adénomes transformés (V4.3, V4.4 et V5)
- V4.3 et V4.4 :
- Exérèse non R0 : coloscopie à 3 mois, puis à 3, 8, 13 et 23 ans tant que la coloscopie est normale
- Exérèse complète R0 : coloscopie à 3, 8, 13 et 23 ans tant que la coloscopie est normale
- V5 avec exérèse complète RO : coloscopie à 3 mois si aucun traitement complémentaire n’a été décidé en RCP. Ce contrôle est en général couplé à une échoendoscopie à la recherche d’adénopathie, et si ce contrôle est normal, on poursuit une surveillance classique avec une coloscopie à 3, 8, 13 et 23 ans comme en cas de chirurgie pour un cancer colique et tant que la coloscopie est normale.
Conclusion
Les villeuses ou LST rectales superficielles, sans risque ganglionnaire, sont toutes traitables endoscopiquement. Une analyse précise des caractéristiques macroscopiques de la lésion permet de faire le choix entre une résection par mucosectomie piecemeal (en l’absence de critère de dégénérescence) ou par dissection sous muqueuse (en cas de présence de critère de dégénérescence).
Le traitement endoscopique doit être choisi en première intention du fait de l’expertise de l’endoscopiste pour déterminer parfaitement les limites latérales des lésions grâce aux endoscopes haute résolution, si besoin en s’aidant de coloration.
Bibliographie
- Kudo S. 1993. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy 25:455-61
- Hurlstone DP, Sanders DS, Cross SS, George R, Shorthouse AJ, Brown S. 2005. A prospective analysis of extended endoscopic mucosal resection for large rectal villous adenomas: an alternative technique to transanal endoscopic microsurgery. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland 7:339-44
- Barendse RM, van den Broek FJ, Dekker E, Bemelman WA, de Graaf EJ, et al. 2011. Systematic review of endoscopic mucosal resection versus transanal endoscopic microsurgery for large rectal adenomas. Endoscopy 43:941-9
- Repici A, Hassan C, De Paula Pessoa D, Pagano N, Arezzo A, et al. 2012. Efficacy and safety of endoscopic submucosal dissection for colorectal neoplasia: a systematic review. Endoscopy 44:137-50
- Park SU, Min YW, Shin JU, Choi JH, Kim YH, et al. 2012. Endoscopic submucosal dissection or transanal endoscopic microsurgery for nonpolypoid rectal high grade dysplasia and submucosa-invading rectal cancer. Endoscopy 44:1031-6
- Niimi K, Fujishiro M, Kodashima S, Goto O, Ono S, et al. 2010. Long-term outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms. Endoscopy 42:723-9
- Deprez PH, Bergman JJ, Meisner S, Ponchon T, Repici A, et al. 2010. Current practice with endoscopic submucosal dissection in Europe: position statement from a panel of experts. Endoscopy 42:853-8
- Kakushima N, Fujishiro M, Kodashima S, Muraki Y, Tateishi A, Omata M. 2006. A learning curve for endoscopic submucosal dissection of gastric epithelial neoplasms. Endoscopy 38:991-5
- Probst A, Golger D, Anthuber M, Markl B, Messmann H. 2012. Endoscopic submucosal dissection in large sessile lesions of the rectosigmoid: learning curve in a European center. Endoscopy 44:660-7
- Kiriyama S, Saito Y, Yamamoto S, Soetikno R, Matsuda T, et al. 2012. Comparison of endoscopic submucosal dissection with laparoscopic-assisted colorectal surgery for early-stage colorectal cancer: a retrospective analysis. Endoscopy 44:1024-30
- Saito Y, Uraoka T, Yamaguchi Y, Hotta K, Sakamoto N, et al. 2010. A prospective, multicenter study of 1111 colorectal endoscopic submucosal dissections (with video). Gastrointestinal endoscopy 72:1217-25
- Kim ES, Cho KB, Park KS, Lee KI, Jang BK, et al. 2011. Factors predictive of perforation during endoscopic submucosal dissection for the treatment of colorectal tumors. Endoscopy 43:573-8
- Isomoto H, Nishiyama H, Yamaguchi N, Fukuda E, Ishii H, et al. 2009. Clinicopathological factors associated with clinical outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms. Endoscopy 41:679-83
- Lambert R, Kudo SE, Vieth M, Allen JI, Fujii H, et al. 2009. Pragmatic classification of superficial neoplastic colorectal lesions. Gastrointestinal endoscopy 70:1182-99
- 2003. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointestinal endoscopy 58:S3-43
- Kudo S, Lambert R, Allen JI, Fujii H, Fujii T, et al. 2008. Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointestinal endoscopy 68:S3-47
- Rembacken BJ, Fujii T, Cairns A, Dixon MF, Yoshida S, et al. 2000. Flat and depressed colonic neoplasms: a prospective study of 1000 colonoscopies in the UK. The Lancet 355:1211-4
- Uraoka T, Saito Y, Matsuda T, Ikehara H, Gotoda T, et al. 2006. Endoscopic indications for endoscopic mucosal resection of laterally spreading tumours in the colorectum. Gut 55:1592-7
- Tanaka S, Sano Y. 2011. Aim to unify the narrow band imaging (NBI) magnifying classification for colorectal tumors: current status in Japan from a summary of the consensus symposium in the 79th Annual Meeting of the Japan Gastroenterological Endoscopy Society. Digestive endoscopy : official journal of the Japan Gastroenterological Endoscopy Society 23 Suppl 1:131-9
- Puli SR, Bechtold ML, Reddy JB, Choudhary A, Antillon MR. 2010. Can endoscopic ultrasound predict early rectal cancers that can be resected endoscopically? A meta-analysis and systematic review. Digestive diseases and sciences 55:1221-9
- Puli SR, Bechtold ML, Reddy JB, Choudhary A, Antillon MR, Brugge WR. 2009. How good is endoscopic ultrasound in differentiating various T stages of rectal cancer? Meta-analysis and systematic review. Annals of surgical oncology 16:254-65
- Detry RJ, Kartheuser A, Kestens PJ. 1993. Endorectal ultrasonography for staging small rectal tumors: technique and contribution to treatment. World journal of surgery 17:271-5; discussion 5-6
- Hurlstone DP, Brown S, Cross SS, Shorthouse AJ, Sanders DS. 2005. High magnification chromoscopic colonoscopy or high frequency 20 MHz mini probe endoscopic ultrasound staging for early colorectal neoplasia: a comparative prospective analysis. Gut 54:1585-9
- Dixon MF. 2002. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut 51:130-1
- Kitajima K, Fujimori T, Fujii S, Takeda J, Ohkura Y, et al. 2004. Correlations between lymph node metastasis and depth of submucosal invasion in submucosal invasive colorectal carcinoma: a Japanese collaborative study. Journal of gastroenterology 39:534-43
Les 5 points forts
- Le diagnostic des tumeurs villeuses du rectum est endoscopique, cet examen est le seul qui puisse déterminer avec précision les limites latérales de la lésion et il permet d’évaluer le risque de dégénérescence.
- Toute lésion comportant un critère de dégénérescence endoscopique doit bénéficier d’une échoendoscopie
- En cas de suspicion de dégénérescence superficielle de la lésion, la dissection sous muqueuse doit être préférée à la mucosectomie.
- En cas de lésion dégénérée, le traitement endoscopique est jugé suffisant si toutes les conditions suivantes sont réunies : résection R0, lésion bien différenciée, absence d’embol lymphatique ou vasculaire, un envahissement en profondeur inférieur à 1000mm au delà de la musculaire muqueuse (sm1).
- Toute lésion dégénérée traitée endoscopiquement doit être discutée en RCP.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION