Cancer colique de stade II : quel traitement adjuvant pour quels patients ?
Objectifs pédagogiques
- Savoir reconnaître les stades II à haut risque
- Connaître les indications d’une chimiothérapie adjuvante
- Connaître les protocoles de chimiothérapie et leurs toxicités
Stades II à haut risque
Données épidémiologiques
Selon la 7e révision de la classification TNM actuellement en vigueur, les tumeurs coliques de stade II regroupent les tumeurs classées T3 (atteignant la sous-séreuse), T4a (pénétration du péritoine viscéral) et T4b (envahissement d’un organe de voisinage), sans atteinte métastatique ganglionnaire ou à distance [1]. On distingue les tumeurs de stade IIA (pT3N0M0), IIb (pT4aN0M0) et IIc (pT4bN0M0). En France, environ un quart des tumeurs coliques sont diagnostiquées au stade II [2].
Après chirurgie à visée curative, la survie relative à 5 ans rapportée par les registres américains du réseau SEER était de 87 % pour les tumeurs T3N0 (stade IIA) et de 71 % pour les tumeurs T4N0, passant de 80 % pour les tumeurs T4aN0 (stade IIB) à 58 % pour les tumeurs T4bN0 (stade IIC) [1]. Il est important de noter que, dans cette même étude, la survie relative à 5 ans des tumeurs de stade IIIA (T1-2N1) était de 87 % et celle des tumeurs de stade IIIB (T1-2N2) de 75 %, confirmant des données plus anciennes qui suggéraient un moins bon pronostic des tumeurs T4 sans envahissement ganglionnaire (stade II) par rapport à des tumeurs moins infiltrantes avec un envahissement ganglionnaire (stade III) [1, 3].
Facteurs pronostiques cliniques et anatomopathologiques
Ces constatations épidémiologiques ont abouti à la notion de stade II « à haut risque » de récidive. Tumeurs de moins bon pronostic qui pourraient bénéficier d’un traitement adjuvant après chirurgie à visée curative. À ce jour, l’identification de ces patients reste un problème non résolu [4]. En effet, la définition d’une tumeur de stade II « à haut risque » repose actuellement sur différents critères cliniques (tumeurs perforées ou en occlusion) ou anatomopathologiques (tumeurs T4, moins de 12 ganglions examinés, adénocarcinome peu différencié, présence d’emboles veineux ou d’engainements périnerveux) [5]. Ces critères n’ont cependant pas tous été validés et ne font pas l’objet d’un consensus.
De nombreux autres facteurs anatomopathologiques ou biologiques pronostiques ont été rapportés, mais ne sont pas utilisés en pratique courante. On peut citer par exemple : ratio neutrophile sur lymphocyte dNLR [6], buding [7], stroma intratumoral [8] ou taux d’ACE [9].
Biomarqueurs moléculaires et scores prédictifs
Plus récemment, plusieurs biomarqueurs moléculaires pronostiques ont été évalués. Il est bien démontré par plusieurs séries prospectives et rétrospectives que la présence d’une instabilité microsatellitaire (MSI+) est un facteur de bon pronostic, tant en termes de survie sans récidive que de survie globale [10, 11]. Une perte d’hétérozygotie en 18q ou une faible expression de SMAD4 seraient également des facteurs pronostiques dans cette situation [10].
L’identification de profils d’expression génomique pourrait permettre d’identifier plus précisément les tumeurs de stade II « à haut risque ». Le score de récidive Oncotype DX (GenomicHealth Inc.) est un test standardisé reposant sur l’analyse par RT-PCR de l’expression de 12 gènes sur des échantillons tumoraux fixés en paraffine. Ce test développé puis validé à partir des données de plusieurs essais randomisés est commercialisé et permet de classer les tumeurs en 3 groupes à risque bas, intermédiaires ou élevés de récidive, de façon indépendante du statut microsatellitaire et des facteurs histopronostiques habituels [12-14]. Le test Coloprint (Agendia, Amsterdam, Pays-Bas), réalisé à partir de prélèvements congelés, est un autre score de récidive basé sur une signature génomique constituée de 18 gènes permettant d’identifier, dans la plupart des cas, les tumeurs de stade II à faible risque de récidive métastatique [15, 16]. Ce test est en cours d’évaluation dans l’essai prospectif PARCS (A Prospective Study for the Assessment of RecurrenceRisk in Stage II Colon Cancer Patients Using ColoPrint) dont les objectifs sont, entre autres, d’évaluer la performance du test dans l’évaluation du taux de récidive à 3 ans de patients ayant une tumeur colique stade II (http://clinicaltrials.gov/show/NCT00903565). Le test ColDx (Almack Group Limited Ltd.) est en cours de développement et pourrait identifier les tumeurs coliques de stade II à haut risque de reprise évolutive à partir d’échantillons fixés en paraffine et analysés par une puce Affymétrix [17]. Citons également les profils génomiques Colo Guide Ex, basé sur l’expression de 132 gènes et développé spécifiquement pour les tumeurs coliques de stade II [18], et Onco Defender-CRC, basé sur l’expression de 5 gènes pour des tumeurs de stade I et II [19], dont le développement est moins avancé et l’intérêt pratique restant encore à démontrer.
Très récemment, une équipe chinoise a décrit une signature pronostique et prédictive basée sur l’expression de 6 microRNAs permettant de différencier les patients à faible et haut risque [20]. La signature était indépendante en analyse multivariée avec une meilleure valeur pronostique que les facteurs de risques clinico-pathologiques habituels ou le statut microsatellitaire. Si ces résultats très intéressants sont confirmés et validés dans d’autres populations, cette signature pourrait modifier les pratiques. Il s’agit en effet d’une technique qui, par rapport aux précédentes signatures génomiques mentionnées, est peu coûteuse et facile d’utilisation [4].
Faut-il proposer une chimiothérapie adjuvante après résection d’une tumeur colique de stade II ?
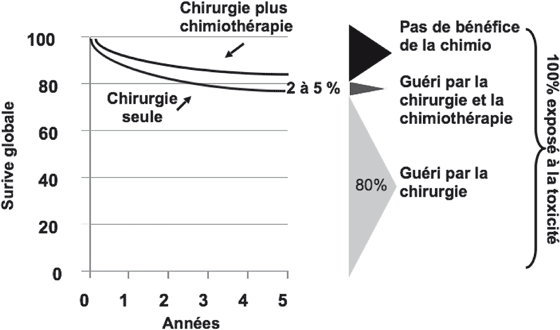
Après chirurgie à visée curative d’un cancer, l’objectif d’une chimiothérapie adjuvante est de diminuer la mortalité par récidive de ce cancer. Le traitement adjuvant, administré à des patients potentiellement guéris par la chirurgie seule, mais dont on considère qu’ils sont à risque élevé de récidive, doit être efficace, bien toléré et sans retentissement significatif sur la qualité de vie des patients. Dans le cas des tumeurs coliques de stade II, le bénéfice d’une chimiothérapie adjuvante reste controversé. En effet, la grande majorité des patients sera guérie par la chirurgie seule et, alors que l’ensemble des patients sera exposé à la toxicité de la chimiothérapie adjuvante, seulement 2 à 5 % d’entre eux en bénéficieront réellement (i.e. seront guéris grâce à la chimiothérapie) (Fig. 1).
Chimiothérapie adjuvante par 5FU
Alors qu’une analyse poolée de 5 essais randomisés ayant inclus plus de 1 000 patients ne montrait pas de bénéfice significatif en termes de survie sans récidive ou de survie globale à 5 ans d’une chimiothérapie adjuvante à base de 5FU seul [21], l’étude QUASAR était en faveur d’un bénéfice de survie, modeste (3 % d’amélioration du taux de survie globale), mais statistiquement significatif chez les patients recevant une chimiothérapie adjuvante (5FU plus acide folinique) par rapport à ceux traités par chirurgie seule [22]. Cette étude anglaise pragmatique peut cependant faire l’objet de critiques méthodologiques. Cet essai a inclus en particulier des tumeurs du rectum et des tumeurs de stade III et, lorsque l’on restreignait l’analyse au groupe des tumeurs coliques de stade II, le bénéfice de la chimiothérapie adjuvante n’était plus significatif: RR = 0,86 (0,66-1,12) [22]. Globalement, il n’existait pas non plus de bénéfice de la chimiothérapie chez les patients âgés de plus de 70 ans.
Cette tendance en faveur d’un bénéfice de survie d’une chimiothérapie adjuvante par 5FU a cependant été confirmée par une importante analyse poolée de 18 essais de phase III réalisés entre 1978 et 1999 [23]. L’analyse du sous-groupe de patients ayant une tumeur colique stade II montre une amélioration significative de la survie globale en cas de chimiothérapie adjuvante avec un taux de survie à 8 ans passant de 66,8 % dans le bras chirurgie seule à 72,2 % dans le bras chirurgie plus chimiothérapie (p = 0,026) [23].
Une étude épidémiologique à partir des données du registre américain SEER, portant sur plus de 24 800 tumeurs coliques de stade II, dont 20 % avaient reçu une chimiothérapie adjuvante et 75 % étaient considérées comme des stades II à haut risque, n’a pas mis en évidence de bénéfice d’une chimiothérapie adjuvante à base de 5FU, que ce soit chez les patients ayant un stade II sans facteur de mauvais pronostic (HR = 1,02, IC95 % : 0,84-1,25) ou chez les patients ayant au moins un facteur de mauvais pronostic (HR = 1,03, IC95 % : 0,94-1,13) [24].
Au total, il existe des arguments en faveur d’un bénéfice d’une chimiothérapie adjuvante à base de 5FU après chirurgie d’une tumeur colique de stade II. Ce bénéfice est cependant très modeste, de l’ordre de quelques pour cent d’amélioration, et non retrouvé dans toutes les études. Les données concernant le cas particulier des stades II à haut risque manquent et aucun bénéfice n’est retrouvé dans l’étude épidémiologique américaine [24].
Chimiothérapie adjuvante par association 5FU + oxaliplatine
Les essais MOSAIC et NSABPC-07, qui ont comparé une chimiothérapie adjuvante par 5FU + oxaliplatine versus 5FU seul, ont inclus à la fois des tumeurs de stade III et de stade II. Dans ces 2 essais, les tests d’interaction stade-traitement étaient non significatifs, suggérant un bénéfice comparable de l’oxaliplatine, quel que soit le stade. Les analyses par sous-groupe ne montrent cependant pas de bénéfices significatifs à l’intensification de la chimiothérapie par l’ajout de l’oxaliplatine pour les tumeurs de stade II [25, 26]. Dans l’essai NSABPC-07, la survie globale à 8 ans passait, en cas de tumeur de stade II, de 89,6 % dans le groupe traité par 5FU seul à 89,7 % en cas de traitement par 5FU + oxaliplatine (HR = 1,04, p = 0,84). Pour ces mêmes groupes, la survie sans récidive à 8 ans passait de 80,1 % à 82,2 % (HR = 0,94, p = 0,67) [25]. L’étude MOSAIC avait inclus 899 patients de stade II dont 330 à faible risque et 569 à haut risque. Globalement pour les tumeurs de stade II, une chimiothérapie adjuvante par FOLFOX n’améliorait pas les taux de survie sans récidive (HR = 0,84, p = 0,26) ou de survie globale (HR = 1,00, p = 0,99) par rapport à une chimiothérapie adjuvante par LV5FU2 [26]. Il existait une tendance significative en faveur d’une amélioration du délai jusqu’à récidive en faveur du bras FOLFOX (HR = 0,70, p = 0,045) [26]. L’analyse chez les patients ayant une tumeur de stade II à faible risque confirmait l’absence de différence entre les 2 bras thérapeutiques. Pour les patients ayant une tumeur de stade II à haut risque et traités par FOLFOX, il existait une tendance non significative en faveur d’une amélioration de la survie sans récidive (HR = 0,72, p = 0,063), mais aucune différence de survie globale à 6 ans (83,3 % versus 85 %, HR = 0,91, p = 0,48) [26].
Individualiser la décision thérapeutique
Il existe donc peu d’arguments en faveur d’un bénéfice d’une chimiothérapie adjuvante par 5FU seul ou 5FU + oxaliplatine dans les tumeurs coliques de stade II, y compris pour les tumeurs considérées à haut risque sur les critères clinico-pathologiques usuels. À ce jour, les nouvelles signatures moléculaires décrites précédemment ne permettent pas non plus d’affirmer que les patients ayant des tumeurs à haut risque vont effectivement bénéficier d’une chimiothérapie adjuvante. Le rôle prédictif de ces signatures moléculaires pronostiques reste à démontrer. L’analyse réalisée avec les données de l’étude QUASAR ne montrait pas de tendance en faveur d’une différence d’efficacité de la chimiothérapie adjuvante selon les trois groupes de risques de récidive définis par le score Oncotype DX [14]. Dans cette étude, le bénéfice relatif de la chimiothérapie, en termes de récidive, était même moins important chez les patients du groupe à haut risque que chez les patients à faible risque [14]. Des études complémentaires sont en cours, en particulier à partir des données de l’étude MOSAIC.
La signature moléculaire basée sur l’expression de certains miRNAs décrite par Zhang et al. permettrait d’identifier les tumeurs coliques de stade II bénéficiant d’une chimiothérapie adjuvante [20]. En effet, les patients classés dans le groupe à haut risque de récidive traités par chimiothérapie présentaient une amélioration significative de leur survie sans maladie par rapport aux patients de ce même groupe ne recevant pas de chimiothérapie adjuvante (HR = 1,69, p = 0,005). Les patients qui bénéficiaient le plus d’une chimiothérapie adjuvante étaient ceux présentant au moins un facteur clinico-pathologique de mauvais pronostic et classés dans le groupe à haut risque par la signature miRNA [20]. Cette signature moléculaire serait donc non seulement pronostique, mais également prédictive de l’efficacité de la chimiothérapie
Cas particulier des tumeurs MSI+
Plusieurs études et une méta-analyse [27] ont permis de conclure que les tumeurs MSI+, de meilleur pronostic, ne bénéficiaient pas d’une chimiothérapie adjuvante. Ceci a été récemment confirmé à partir de l’étude QUASAR qui regroupait plus de 90 % de tumeurs de stade II [28]. Une autre étude réalisée à partir des données poolées de différents essais randomisés suggère même qu’une chimiothérapie adjuvante à base de 5 FU serait délétère chez les patients ayant une tumeur de stade II [29]. En cas de tumeur colique MSI+ de stade II, il ne faut donc pas proposer de chimiothérapie adjuvante par 5FU.
Recommandations du Thésaurus National de Cancérologie Digestive
Basées sur les données décrites ci-dessus, les recommandations actuelles du Thésaurus National de Cancérologie Digestive concernant le traitement adjuvant des tumeurs coliques de stade II sont les suivantes :
- Pas de chimiothérapie en l’absence de facteur de mauvais pronostic reconnu (référence).
- En cas d’instabilité microsatellite tumorale, une chimiothérapie adjuvante par 5FU n’est pas recommandée (grade B).
- En cas de tumeur de stade II « à haut risque » (tumeurs perforées ou en occlusion, tumeurs T4, moins de 12 ganglions examinés, adénocarcinome peu différencié, présence d’emboles veineux ou d’engainements périnerveux), les données actuelles ne permettent pas d’avoir un niveau de preuve suffisant pour conclure. Il n’y a donc pas de référence dans cette situation et le TNCD propose différentes options dont le niveau est celui d’accord d’experts : « une chimiothérapie peut être proposée aux patients n’ayant pas de comorbidité, en bon état général. En l’absence de preuves de niveau A d’efficacité et de consensus dans cette situation, la prudence est souhaitable ainsi que l’explication aux patients de la balance bénéfices-risques. Les schémas proposés doivent avoir peu de risques toxiques : LV5FU2, fluoropyrimidine oral, voire FOLFOX-4. En cas d’utilisation du protocole FOLFOX-4, l’oxaliplatine devra être interrompue dès l’apparition d’une neurotoxicitéde grade 2 persistante ».
Références
- Gunderson LL, Jessup JM, Sargent DJ, et al. Revised tumor and node categorization for rectal cancer based on surveillance, epidemiology, and end results and rectal pooled analysis outcomes. J Clin Oncol 2010;28: 256-63.
- Phelip JM, Molinie F, Delafosse P, et al. A population-based study of adjuvant chemotherapy for stage-II and -III colon cancers. Gastroenterol Clin Biol 2010;34:144-9.
- O’Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst 2004;96: 1420-5.
- Watanabe T. Biomarker for high-risk patients with stage II colon cancer. Lancet Oncol 2013;14:1247-8.
- Niedzwiecki D, Bertagnolli MM, Warren RS, et al. Documenting the natural history of patients with resected stage II adenocarcinoma of the colon after random assignment to adjuvant treatment with edrecolomab or observation: results from CALGB 9581. J Clin Oncol 2011;29:3146-52.
- Absenger G, Szkandera J, Pichler M, et al. A derived neutrophil to lymphocyte ratio predicts clinical outcome in stage II and III colon cancer patients. Br J Cancer 2013;109: 395-400.
- Nakamura T, Mitomi H, Kanazawa H, et al. Tumor budding as an index to identify high-risk patients with stage II colon cancer. Dis Colon Rectum 2008;51:568-72.
- Huijbers A, Tollenaar RA, v Pelt GW, et al. The proportion of tumor-stroma as a strong prognosticator for stage II and III colon cancer patients: validation in the VICTOR trial. Ann Oncol 2013;24:179-85.
- Quah HM, Chou JF, Gonen M, et al. Identification of patients with high-risk stage II colon cancer for adjuvant therapy. Dis Colon Rectum 2008;51:503-7.
- Roth AD, Delorenzi M, Tejpar S, et al. Integrated analysis of molecular and clinical prognostic factors in stage II/III colon cancer. J Natl Cancer Inst 2012;104:1635-46.
- Popat S, Hubner R, Houlston RS. Systematic review of microsatellite instability and colorectal cancer prognosis. J Clin Oncol 2005;23:609-18.
- Yothers G, O’Connell MJ, Lee M, et al. Validation of the 12-Gene Colon Cancer Recurrence Score in NSABP C-07 As a Predictor of Recurrence in Patients With Stage II and III Colon Cancer Treated With Fluorouracil and Leucovorin (FU/LV) and FU/LV Plus Oxaliplatin. J Clin Oncol 2013.
- Venook AP, Niedzwiecki D, Lopatin M, et al. Biologic determinants of tumor recurrence in stage II colon cancer: validation study of the 12-gene recurrence score in cancer and leukemia group B (CALGB) 9581. J Clin Oncol 2013;31:1775-81.
- Gray RG, Quirke P, Handley K, et al. Validation study of a quantitative multigene reverse transcriptase-polymerase chain reaction assay for assessment of recurrence risk in patients with stage II colon cancer. J Clin Oncol 2011;29:4611-9.
- Salazar R, Roepman P, Capella G, et al. Gene expression signature to improve prognosis prediction of stage II and III colorectal cancer. J Clin Oncol 2011;29:17-24.
- Maak M, Simon I, Nitsche U, et al. Independent validation of a prognostic genomic signature (ColoPrint) for patients with stage II colon cancer. Ann Surg 2013;257:1053-8.
- Kennedy RD, Bylesjo M, Kerr P, et al. Development and Independent Validation of a Prognostic Assay for Stage II Colon Cancer Using Formalin-Fixed Paraffin-Embedded Tissue. J Clin Oncol 2011;29: 4620-6.
- Agesen TH, Sveen A, Merok MA, et al. ColoGuideEx: a robust gene classifier specific for stage II colorectal cancer prognosis. Gut 2012;61:1560-7.
- Lenehan PF, Boardman LA, Riegert-Johnson D, et al. Generation and external validation of a tumor-derived 5-gene prognostic signature for recurrence of lymph node-negative, invasive colorectal carcinoma. Cancer 2012;118:5234-44.
- Zhang JX, Song W, Chen ZH, et al. Prognostic and predictive value of a microRNA signature in stage II colon cancer: a microRNA expression analysis. Lancet Oncol 2013;14: 1295-1306.
- Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol 1999;17:1356-63.
- Quasar Collaborative G, Gray R, Barnwell J, et al. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet 2007;370: 2020-9.
- Sargent D, Sobrero A, Grothey A, et al. Evidence for cure by adjuvant therapy in colon cancer: observations based on individual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol 2009; 27:872-7.
- O’Connor ES, Greenblatt DY, LoConte NK, et al. Adjuvant chemotherapy for stage II colon cancer with poor prognostic features. J Clin Oncol 2011;29:3381-8.
- Yothers G, O’Connell MJ, Allegra CJ, et al. Oxaliplatin As Adjuvant Therapy for Colon Cancer: Updated Results of NSABP C-07 Trial, Including Survival and Subset Analyses. J Clin Oncol 2011;29:3768-74.
- Tournigand C, Andre T, Bonnetain F, et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol 2012;30:3353-60.
- Des Guetz G, Schischmanoff O, Nicolas P, et al. Does microsatellite instability predict the efficacy of adjuvant chemotherapy in colorectal cancer? A systematic review with meta-analysis. Eur J Cancer 2009;45: 1890-6.
- Hutchins G, Southward K, Handley K, et al. Value of mismatch repair, KRAS, and BRAF mutations in predicting recurrence and benefits from chemotherapy in colorectal cancer. J Clin Oncol 2011;29:1261-70.
- Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010;28:3219-26.
Les Cinq points forts
-
Une chimiothérapie adjuvante pour les tumeurs de stade II « à faible risque de récidive » n’est pas indiquée : absence de bénéfice de survie, et exposition aux risques de toxicité.
-
En cas de tumeurs coliques de stade II « à haut risque », selon les critères cliniques et anatomopathologiques habituels, une chimiothérapie adjuvante pourrait être utile bien que son intérêt ne soit pas formellement démontré.
-
Chez ces patients potentiellement guéris par la chirurgie seule, le ratio bénéfice/risque est particulièrement important à prendre en compte.
-
Ajouter l’oxaliplatine au 5FU majore le risque de toxicité, en particulier hématologique et neurologique, sans qu’un bénéfice de survie n’ait été montré.
-
Les tumeurs de stade II ayant une instabilité microsatellitaire (MSI+) sont de bon pronostic et une chimiothérapie adjuvante n’est pas recommandée.
-
Des signatures moléculaires ont montré leur intérêt pronostique en identifiant des groupes à risque élevé de récidive. Si leur rôle prédictif est démontré, elles pourraient à l’avenir être utilisées pour identifier les tumeurs de stade II pour lesquelles il faut proposer une chimiothérapie adjuvante.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION