Prurit anal : ce qu’il faut faire et ne pas faire…
Objectifs pédagogiques
- Définition du prurit anal essentiel
- Diagnostic
- Diagnostic différentiel, quand et que faut-il biopsier ?
- Traitement
Abréviations
PA : prurit anal
IST : infection sexuellement transmise
AMM : autorisation de mise sur le marché
« Il est plus facile de se gratter le cul que le cœur » (Francis Picabia, poète français)
Définition et épidémiologie
Le prurit anal (PA) représente un motif courant de consultation en médecine générale mais aussi en proctologie et en dermatologie [1]. C’est un véritable symptôme qui se définit comme l’ensemble des sensations cutanées (habituellement démangeaison ou brûlure) aboutissant au besoin plus ou moins impérieux de se gratter l’anus et/ou le canal anal [1-7] et qui peut s’étendre au pli interfessier, au scrotum, à la vulve, aux plis inguinaux, voire aux régions glutéales (fesses).
Le PA est fréquemment sous-diagnostiqué car souvent passé sous silence par les patients et rarement recherché par les médecins, si bien que son incidence réelle est mal connue. Elle est estimée entre 1 et 5 % de la population générale [4, 5]. Tous les auteurs s’accordent pour dire qu’il affecte plus souvent les hommes que les femmes avec un sex ratio variant de 2 à 4 selon les études [8, 9]. Il touche surtout la tranche d’âge 40-60 ans [2, 3, 9, 10].
Dans une enquête récente, réalisée chez 10 000 personnes, 412 ont eu une symptomatologie anale au cours des 12 derniers mois, et parmi eux 53 % ont présenté un PA [11].
Le PA peut avoir de nombreuses étiologies : plus d’une centaine est connue et la majorité des causes est bénigne [3]. En pratique courante, on distingue le PA essentiel ou idiopathique (lorsque aucune cause n’est retrouvée) et le PA secondaire [1-4]. Même si le PA idiopathique représente 25 à 75 % des situations [1, 12], il ne doit pas être d’emblée qualifié de psychogène bien que les facteurs psychologiques paraissent être les seuls en cause.
Le retentissement social ou professionnel du PA est variable selon son intensité, son ancienneté et il peut perturber le sommeil. Dans plus de 50 % des cas, il existe depuis plus de 12 mois [5] et le besoin constant et irrépressible de se gratter peut être responsable de certaines situations sociales très embarrassantes (réduction des contacts affectifs, surmédicalisation, voire arrêts de travail répétés). Certains patients peuvent en tirer un bénéfice, voire un plaisir pouvant aboutir à une pathomimie.
Physiopathologie
Elle est complexe et mal élucidée. C’est une sous-population des fibres C sensitives (non myélinisées) qui transmet la sensation prurigineuse jusqu’au niveau du système nerveux central. La sensation prurigineuse peut être obtenue soit directement par une stimulation de nocicepteurs présents sur les fibres C sensitives, soit indirectement par libération locale de médiateurs (histamine en particulier, mais aussi sérotonine, prostaglandines, cytokines, opioïdes endogènes, neuropeptides) qui vont agir sur les récepteurs spécifiques présents sur les terminaisons nerveuses [5, 6, 13, 14].
Il a été démontré par exemple que la présence de matières fécales sur la marge anale peut déclencher une irritation avec prurit dans 40 % des cas, par libération d’endopeptidases bactériennes [15]. De même les protéases du bol fécal, en excès dans les selles lors de diarrhée, semblent impliquées dans la survenue de dermites péri-anales.
Le rôle des suintements fécaux (soiling) a été évoqué chez certains patients étiquetés « PA essentiel », chez qui les explorations fonctionnelles avaient montré un certain nombre d’anomalies : seuil d’incontinence plus bas au test de perfusion saline, relaxation du sphincter anal interne après consommation de café, relaxation plus précoce, d’amplitude supérieure et plus prolongée après distension rectale au ballonnet, relaxations transitoires du sphincter anal interne plus longues et plus amples [15-19]. Ces patients sont repérables par la présence de traces de selles dans les sous-vêtements et/ou sur la peau péri-anale.
Une hypersensibilité des récepteurs à la capsaïcine exprimée par les fibres nerveuses sensitives cutanées sensibles à la chaleur et à l’alcool a été aussi évoquée [20]. La capsaïcine, après application locale, entraîne une déplétion des terminaisons nerveuses -cutanées, surtout en substance P (neuropeptide) et réduit le prurit de différentes affections dermatologiques (dermatite atopique, urticaire, lichen plan) [6].
La région anale a une innervation -sensitive très développée et son « environnement » explique qu’elle soit particulièrement exposée à des facteurs locaux d’irritation :
- les défécations (surtout les selles liquides) ;
- les soins de toilette par défaut ou le plus souvent par excès (mode d’essuyage, abus de certains savons ou antiseptiques) ;
- la richesse en plis cutanés de voisinage (plis génito-cruraux et surtout sillon interfessier) ;
- les facteurs uro-gynécologiques (cystite, leucorrhées, etc.) ;
- les vêtements ou sous-vêtements synthétiques ou trop hermétiques favorisant la rétention sudorale.
Quelle que soit l’origine du PA, le grattage provoque des érosions traumatiques cutanées (aboutissant avec le temps à une lichénification de la peau), elle-même responsable de prurit et de sa pérennisation. Un cercle vicieux auto-entretenu s’installe alors et s’avère difficile à rompre.
Démarche diagnostique
La recherche de la cause repose sur l’interrogatoire et l’examen clinique.
L’interrogatoire doit préciser :
- l’ancienneté du prurit ;
- l’extension du prurit à l’ensemble du périnée, aux organes génitaux, aux plis inguino-cruraux ;
- l’horaire, la rythmicité, les circonstances d’apparition (troubles intestinaux, application de topiques, situations de stress, la prise de certains aliments) ;
- l’existence d’une humidité anormale de l’anus ;
- les habitudes d’hygiène et vestimentaires (vêtements serrés, chaleur, transpiration, essuyage appuyé) ;
- la profession (station assise prolongée, travaux de force avec sudation importante) ;
- la présence d’enfants en bas âge à la maison (transmission des œufs d’oxyures) ;
- la notion de voyages en pays d’endémie parasitaire ;
- le terrain allergique personnel et/ou familial ;
- les prises médicamenteuses systémiques (antibiotique à large spectre en particulier) ou en application locale ;
- l’existence de signes fonctionnels associés : brûlures, rectorragies, troubles du transit.
L’examen clinique de la marge anale doit avoir deux objectifs :
1) apprécier la réalité et l’intensité du prurit :
- les lésions récentes, secondaires au grattage, se caractérisent par des excoriations et des rhagades superficielles situées dans les plis de la marge, sources de brûlures et de saignements ;
- les lésions chroniques sont quant à elles blanchâtres, leucodermiques avec un épaississement des plis aboutissant à la lichénification ;
- des souillures fécales en stries dans les sous-vêtements sont témoins d’un malade qui se gratte de façon compulsive à travers ses vêtements.
Gordon et al. [21] ont proposé une classification en quatre stades des lésions cutanées :
- stade 0 : peau normale
- stade 1 : peau érythémateuse et inflammée
- stade 2 : présence de plages lichénifiées blanchâtres
- stade 3 : présence de plages lichénifiées avec des plis radiés de l’anus épaissis et des ulcérations fréquentes.
2) rechercher localement la cause du prurit :
L’étude de la périphérie lésionnelle revêt une grande importance diagnostique, surtout dans les lésions cutanées érythémateuses. Des lésions spécifiques sont d’emblée évocatrices d’une dermatose (psoriasis, condylomes, lichen scléreux). Toute ulcération génitale ou anale aiguë doit faire rechercher une infection sexuellement transmise (IST) et toute ulcération chronique doit faire rechercher un cancer.
Un toucher anal et rectal avec un examen endoscopique de l’anus et du rectum (anuscopie ± rectoscopie sans préparation préalable) sont indispensables, en particulier en l’absence de lésion cutanée visible.
Selon l’orientation diagnostique, l’examen devra se poursuivre par un examen locorégional génital (verge chez l’homme ; lèvres, vagin et col utérin chez la femme) et la palpation des creux inguinaux à la recherche d’adénopathies (signe très évocateur de certaines IST ou de cancer). Un examen de la peau dans son ensemble (recherche de localisations dermatologiques extra-anales) et des muqueuses (buccale, génitale) doit être associé systématiquement à un examen physique général pour ne pas méconnaître une affection systémique.
Dans cette région occluse, il est souvent difficile de faire la part entre les lésions primitives à l’origine du PA, et les lésions secondaires à la macération et au grattage, à la surinfection et/ou à l’emploi de substances irritatives locales.
Examens complémentaires
En pratique courante, les examens complémentaires sont peu utiles et doivent être demandés au cas par cas. Ils doivent être réfléchis et ciblés pour être rentables.
Par exemple, il est inutile de réaliser des biopsies des lésions de grattage isolées qui n’apporteront pas de nouveaux éléments au diagnostic. En revanche, des lésions focales, chroniques, infiltrées ou atypiques imposent une biopsie cutanée pour confirmer une suspicion clinique de lésion spécifique. Il est alors recommandé de faire au moins un prélèvement à cheval entre zone saine et zone pathologique.
Dans certains PA persistants, les prélèvements à la recherche d’une dermatose infectieuse mycosique ou bactérienne peuvent être envisagés. Ils doivent être pratiqués avant l’utilisation de gel lubrifiant pour le toucher rectal, lequel possède une activité bactéricide, et placés dans des milieux de transport adaptés. Un patch test à la recherche d’une dermite allergique peut être également discuté [22, 23]. Dasan et al. ont ainsi montré l’existence d’une dermite de contact d’hypersensibilité liée aux topiques utilisés, chez plus de la moitié de leurs patients [22].
Chez les patients de plus de 50 ans, le recours à la coloscopie doit être discuté devant tout PA persistant et réfractaire au traitement. Dans une série ancienne prospective de 109 patients, où tous les patients avaient eu une coloscopie, les auteurs avaient retrouvé une fréquence de 23 % de néoplasie anale ou recto-colique [7].
Les examens fonctionnels proctologiques (manométrie ano-rectale, défécographie) sont discutés là aussi au cas par cas après examen par le proctologue.
Chez les patients ne répondant pas au traitement habituel, une cause systémique doit être éliminée et un bilan biologique est recommandé (IgE, glycémie, NFS, plaquettes, CRP, électrophorèse des protéines, urée, créatinine, calcémie, phosphorémie, bilan hépatique, bilan martial, anticorps anti-transglutaminases, bilan thyroïdien, vitamine D).
Étiologies du prurit anal
En pratique quotidienne, une cause précise n’est retrouvée que dans 50 % des cas environ. Pour autant, le PA idiopathique ou essentiel reste un diagnostic d’élimination.
Les causes du PA secondaire se divisent principalement en deux grands groupes :
- les causes proctologiques : leur point commun est l’existence d’un suintement anal (fécal, purulent ou séro-muqueux). Elles seraient à l’origine du prurit dans 75 % des cas : pathologie hémorroïdaire (20 %), fissure anale (12 %) [7] ;
- les causes dermatologiques : elles sont essentiellement constituées par les localisations anales des dermatoses. Elles se caractérisent par des remaniements fréquents liés aux frottements et à la macération et sont souvent surinfectées.
Toutefois, il ne faut pas méconnaître une cause générale comme le diabète sucré.
Causes proctologiques
Lésions à l’origine d’une suppuration
- fistule anale avec orifice externe et écoulement purulent ;
- sinus pilonidal infecté ;
- glande anale sous-pectinéale (anciennement dites glandes à musc) infectée ;
- fissure infectée ;
- maladie de Verneuil.
Lésions à l’origine d’un suintement
- hémorroïdes au stade de prolapsus (Fig. 1) ou marisques hypertrophiques responsables de difficultés d’essuyage en sachant que les pommades anti-hémorroïdaires seraient plus volontiers la cause du PA que les hémorroïdes elles-mêmes ;
- glande anale sous-pectinéale située au pôle antérieur et dont la pression fait sourdre une « goutte de rosée » ;
- dysfonctionnement recto-sphinctérien : il devra être évoqué en -présence d’une dyschésie, d’une hypocontinence, de suintements muqueux ou surtout fécaux. Les étiologies en sont nombreuses :
- atteinte rectale : perte de la contractibilité rectale responsable d’un résidu rectal capable de fuir, surtout en cas de selles molles, diminution de la fonction réservoir (rectite radique, recto-colite hémorragique, maladie de Crohn), prolapsus rectal, rectocèle ;
- atteinte sphinctérienne : séquelles de chirurgie proctologique ou obstétricale, atteinte fonctionnelle du sphincter interne (anomalies du réflexe recto-anal inhibiteur et relaxations transitoires sphinctériennes allongées responsables de soiling), périnée descendant, anisme ;
- enfin, toute diarrhée aiguë ou chronique, quelle qu’en soit la cause, peut par le suintement, l’humidité, l’anite qu’elle engendre, être la cause d’un PA.
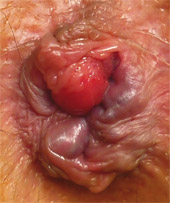
Figure 1. Prolapsus hémorroïdaire
Lésions à l’origine d’une ulcération
- fissure anale avec sa douleur caractéristique ;
- maladie de Crohn ;
- ulcération vénérienne (syphilis, infection à Chlamydia, etc.) ;
- autres : tuberculose, traumatisme, etc.
Lésions à l’origine d’une tumeur
- condylomes (Fig. 2) ;
- carcinome épidermoïde anal ;
- polype rectal, en particulier polype villeux, responsable de suintements ;
- cancer colorectal.

Figure 2. Condylomes
Prurit postopératoire
Après intervention proctologique, la phase de cicatrisation est souvent prurigineuse.
Causes dermatologiques
Dermatoses infectieuses
Bactériennes
Le staphylocoque et le streptocoque pyogène sont fréquemment retrouvés sur les prélèvements locaux, mais ils ne traduisent le plus souvent que la surinfection des lésions de grattage. La fréquence du gîte anal pour le staphylocoque doré impose la prudence dans son imputation et explique la fréquence des surinfections.
Une forme clinique particulière, rencontrée surtout chez l’enfant entre 1 et 8 ans, est la dermite à streptocoque béta-hémolytique du groupe A. De fréquence inconnue chez l’adulte, elle serait surtout due au streptocoque du groupe B (commensal du tube digestif). L’infection se caractérise par un érythème péri-anal en plaques, à collerette de desquamation périphérique fine A (Fig. 3), responsable de prurit, de fièvre et de défécations douloureuses. Le traitement repose sur l’antibiothérapie générale (amoxicilline) pendant 10 à 15 jours.

Figure 3. Dermite à streptocoque béta-hémolytique du groupe A
(coll. Olivier Kaufman)
L’érythrasma, dû à Corynebacterium minutissimum, constitue une cause possible mais rare. Il s’agit d’une lésion chamoisée finement squameuse, sans aspect de guérison central, sans pustule ou vésicule, donnant en lumière de Wood une fluorescence rouge corail. Le prélèvement affirme le diagnostic. Le traitement repose sur les macrolides en topique (érythomycine crème pendant 14 jours) ou per os (érythromycine 250 mg 4/jour pendant 14 jours, ou clarithromycine monodose) ou l’acide fusidique en topique.
Mycosiques
Les candidoses péri-anales sont très prurigineuses et fréquentes (15 % des causes de PA) [16]. Les facteurs favorisants sont bien connus : diabète sucré, obésité, antibiothérapie, déficit immunitaire, abus de corticoïdes locaux ou de savons acides, manque d’hygiène, transpiration, macération. Le PA s’associe à un érythème vernissé, inflammatoire, humide de la marge anale, avec collerette épidermique émiettée et pustules périphériques très évocatrices A (Fig. 4), s’étendant volontiers dans le pli interfessier (alors souvent recouvert d’un enduit blanchâtre) et/ou les organes génitaux (atteinte en sablier ano-génitale très évocatrice aussi) et pouvant s’accompagner d’une fissure. Il faut exiger la présence de nombreuses colonies de Candida albicans à l’examen mycologique pour retenir le diagnostic car le candida est un germe saprophyte de l’anus. Le traitement repose sur les antifongiques locaux (éconazole en solution ´ 2/jour ou kétoconazole en une application/jour, pendant 1 à 3 semaines). Il faut éviter les savons à pH acide. La crème s’adapte aux formes peu suintantes et les poudres aux zones très humides.

Figure 4. Candidose
Les dermatophyties péri-anales sont exceptionnelles. Elles prennent l’aspect d’un érythème cutané à bordure vésiculeuse ou squameuse, à extension centrifuge avec guérison centrale donnant un aspect circiné caractéristique. Elles sont dues le plus fréquemment à Trichophyton rubrum. Le diagnostic est confirmé par le prélèvement à la curette des squames périphériques. Le traitement repose sur un antifongique local (terbinafine) et souvent un traitement par voie générale (terbinafine, fluconazole, itraconazole).
Virales
L’herpès de primo-infection ou récurrent, les molluscum contagiosum et les condylomes peuvent entraîner un -prurit.
Parasitaires
L’oxyurose, due à Enterobius vermicularis, est la cause la plus fréquente, caractérisée par un prurit vespéral chez les enfants et les adultes vivant en collectivité, et qui répond bien au traitement de toute la famille par flubendazole (une dose à J1 et à J21) associé à la désinfection du linge et de la literie.
En dehors de la gale (Sarcoptes Scabei homini) et des morpions (Phtirius inguinalis), il existe un certain nombre d’agents susceptibles d’entraîner un PA : lambliase, tæniase, ascaridiase, amibiase cutanée.
Dermatoses inflammatoires :
Le psoriasis inversé de la marge anale se manifeste par la survenue d’un intertrigo péri-anal chronique s’étendant au sillon interfessier, symétrique, à limites nettes, à surface finement squameuse et parfois fissuraire (Fig. 5). Cet intertrigo est rattaché au psoriasis soit par la biopsie, soit par la survenue d’autres localisations typiques (cuir chevelu, coudes, genoux, ongles). Le traitement de référence est l’application de corticoïdes.

Figure 5. Psoriasis
L’eczéma se manifeste par un prurit intense. À la phase aiguë, les lésions associent érythème, œdème, suintement et vésicules notamment en périphérie. À la phase chronique, on retrouve des lésions de lichénification (plaques épaisses, blanc grisâtres, excoriées par le grattage).
La forme irritative ou caustique est la plus fréquente. On en distingue globalement cinq cadres étiologiques :
- hygiène : essuyage trop méticuleux, trop énergique, savon, déodorant, parfum, papier de toilette coloré et parfumé ;
- médicaments locaux : gels, crèmes, pommades, solutions, suppositoires, de tous types. Antiseptiques, anesthésiques, antibiotiques, antihistaminiques, anti-inflammatoires, anti-hémorroïdaires, huile de paraffine (responsable de suintement anal surtout en cas de prise vespérale). Les corticoïdes locaux peuvent également contenir des agents sensibilisateurs conduisant une réapparition des symptômes après une phase initiale d’efficacité ;
- vêtements : les produits synthétiques comme le nylon ou le tergal sont très irritants de même que le caoutchouc, les vêtements teints, les protections périodiques mais aussi les sous-vêtements serrés et hermétiques ;
- aliments : certains produits renfermant des colorants (bonbons, guimauves) ;
- irritation directe rapportée chez les sportifs (jogger, cycliste), les obèses à pilosité excessive et les personnes présentant une hyperhidrose locale majeure.
La forme allergique de contact est également fréquente. Elle suit une période de sensibilisation silencieuse au cours de laquelle se développe une réaction immunitaire vis-à-vis de produits topiques (savons, parfums, déodorants, produit de lavage (lessives, assouplisseurs, etc.), latex, papiers de toilette, topiques locaux, serviettes hygiéniques, etc.).
Les localisations anales de l’eczéma atopique sont rares et non isolées, le siège électif des lésions étant les plis du coude, les creux poplités, les sillons rétro-auriculaires.
La dermite séborrhéique se présente sous la forme de plaques érythémateuses ou orangées à limites floues recouvertes de squames grasses jaunâtres surtout en périphérie. Il faut rechercher d’autres lésions identiques très évocatrices du diagnostic au niveau de la lisière du cuir chevelu, des sillons nasogéniens et de la gouttière présternale (zones de tégument les plus riches en glandes sébacées). Certains facteurs favorisants sont bien connus : stress, alcool, syndromes extra-pyramidaux, hypersudation. Le traitement repose sur les dermocorticoïdes de classe 4 (Tableau I).
Tableau I. Nouvelle classification internationale 2004
des principaux dermocorticoïdes utilisés en France
en fonction de leur activité anti-inflammatoire
Classes (activité anti-inflammatoire) Principales spéc
| Classes (activité anti-inflammatoire) | Principales spécialités |
|---|---|
| • 1 (faible) | Hydrocortisone crème Astier®, Hydracort®… |
| • 2 (modérée) | Tridesonit®, Célestoderm relais®, Locapred®… |
| • 3 (forte) | Betneval®, Diprosone®, Locoïd®, Nérisone®… |
| • 4 (très–forte) | Dermoval®, Diprolène®… |
Dermatoses tumorales
Certaines tumeurs cutanées peuvent être responsables de prurit : maladie de Bowen, maladie de Paget, carcinome baso-cellulaire, mélanome.
La maladie de Bowen touche surtout la femme, à la période de la ménopause, mais aussi la population homosexuelle masculine infectée par le virus de l’immuno-déficience humaine. C’est une néoplasie intra-épithéliale anale de haut grade en zone cutanée, liée aux papillomavirus humains. Elle se manifeste sous la forme d’une lésion unique, leucoplasique ou érythroplasique, infiltrée (Fig. 6), ou parfois d’une lésion ulcérée infiltrée qui impose une biopsie. Le traitement est la chirurgie d’exérèse en raison du risque de carcinome invasif.

Figure 6. Maladie de Bowen
La maladie de Paget anale est exceptionnelle. Elle se présente habituellement comme un placard érythémato-squameux rouge vermeil, à limites nettes, infiltré (Fig. 7). Parfois la lésion est purement érythroplasique ou leucoplasique ou végétante. Le diagnostic est histologique. Elle s’associe fréquemment à un cancer profond colorectal, urogénital ou mammaire qu’il faudra rechercher. Le traitement est habituellement chirurgical.

Figure 7. Maladie de Paget
Autres dermatoses prurigineuses
Le lichen scléreux ne touche la région anale que chez la femme aux âges extrêmes de la vie (enfant ou après la ménopause) sous forme de papules blanchâtres brillantes, groupées en placard atrophique ano-vulvaire. Le diagnostic repose sur l’histologie et le traitement sur la corticothérapie locale ; une surveillance régulière s’impose en raison du risque de dégénérescence en carcinome épidermoïde.
Le lichen plan se présente quant à lui sous forme de papules rouges violines, lisses, brillantes, indurées avec des stries blanches (Fig. 8) ; la présence de lésions identiques très prurigineuses au niveau des poignets est très évocatrice de même que certaines lésions muqueuses (stries ou arborisation en feuille de fougère blanchâtres, brillantes, indolores à la face interne des joues, le dos de la langue, les gencives, les lèvres). Le diagnostic est basé sur la biopsie et le traitement sur les corticoïdes locaux.
Figure 8. Lichen plan
Le pemphigus bénin familial ou maladie de Hailey-Hailey se localise de façon élective au niveau des plis. Il appartient au cadre nosologique des maladies bulleuses, caractérisé par une phase bulleuse très éphémère aboutissant à des plages érythémateuses humides, parcourues par des rhagades caractéristiques notamment au niveau ano-inguinal. Le diagnostic repose sur l’histologie.
Causes uro-gynécologiques
Il s’agit surtout des leucorrhées, quelle qu’en soit l’étiologie (plus volontiers trichomonase et candidose) et de l’incontinence urinaire.
Causes systémiques
Il faut les garder en mémoire pour ne pas « psychiatriser » abusivement certains patients [24] : post-ménopause (prurit volontiers ano-génital lié à la xérose cutanéo-muqueuse), grossesse (modifications hormonales responsables d’hypersécrétions vaginales), syndrome sec de Gougerot-Sjögren, anémie hypochrome, diabète sucré (dysfonctionnement sphinctérien et/ou surinfection fréquente), dysthyroïdie, insuffisance rénale, hyperuricémie, lymphomes, polyglobulie, ictère, hypovitaminose A, B, D, maladie cœliaque…
Causes médicamenteuses et alimentaires
Certains médicaments administrés per os (colchicine, quinidine, telaprevir, néomycine, nicorandil) ou en perfusion (gemcitabine) ont été incriminés (PA dans 29 % des cas sous telaprevir) ainsi que des traitements locaux (suppositoire d’ergotamine ou d’anti-inflammatoires non stéroïdiens, bains de permanganate de potassium, etc.).
Certains aliments ont été également mis en cause : tomate (par le biais de l’histamine), citron, raisins, figues, prune, épices, produits laitiers, bière, vin, sodas, moutarde, café décaféiné ou non, thé, chocolat, cacahuètes, noisettes. La plupart agirait par une baisse des pressions du sphincter interne. Certains travaux ont montré une amélioration significative du PA après 14 jours de régime mais aucun essai contrôlé n’a montré d’efficacité d’un régime d’exclusion [3, 25, 26].
Prurit anal essentiel
Sa fréquence est estimée à près d’un patient sur deux. En fait, lorsque aucune cause n’est identifiée, soit la cause initiale a disparu (le PA est pérennisé par auto-entretien) soit, bien que très discuté, une origine psychogène est évoquée [27].
On a souvent pensé que le PA pouvait être l’expression d’un trouble névrotique ou dépressif (sujet hypocondriaque, cancérophobe, anxieux avec insomnie et irritabilité, hystérique ou obsessionnel avec tendance aux soins locaux excessifs). En effet, la région anale n’est pas neutre psychologiquement [28]. La théorie freudienne du développement de la personnalité à l’âge de l’apprentissage de la propreté a montré l’existence d’une « phase anale » d’où découle en psychanalyse le « caractère anal » (méticulosité, propreté, scrupules, tendance aux doutes, rationalité intellectuelle). La région anale est aussi une zone érogène et selon une interprétation psychanalytique, le grattage aboutissant à une satisfaction quasi orgasmique, le PA pourrait traduire une composante homosexuelle chez l’homme, une insatisfaction affective sexuelle chez la femme. Cette notion d’insatisfaction a été par la suite étendue à la sphère professionnelle. Certains interprètent le PA comme un retournement contre soi-même d’une agressivité impossible à manifester autrement.
D’autres études n’ont retrouvé aucun trouble comportemental particulier chez les patients souffrant de PA et il serait donc abusif de « psychiatriser » tous les patients [16, 27]. Toutefois, il est indéniable que des facteurs comme l’anxiété et les problèmes personnels ou socio-économiques sont fréquents chez ces patients, si bien qu’un entretien particulièrement long avec une bonne écoute favorisant une relation médecin/malade empreinte de confiance, permettra une meilleure prise en charge thérapeutique. Il est par ailleurs probable que l’évolution chronique d’un PA puisse, comme tout autre affection, retentir sur l’équilibre psychique d’un patient.
Quand les facteurs psychologiques paraissent être les seuls en cause dans le déclenchement du prurit, dans son caractère récidivant et /ou chronique, le PA s’inscrit dans la pathologie fonctionnelle. Son expression clinique est variable depuis une sensation voluptueuse conduisant à des accès de démangeaison sources de plaisir à une sensation douloureuse incoercible provoquant des lésions cutanées secondaires pouvant réaliser parfois de -véritables mutilations [6]. Certaines particularités cliniques peuvent évoquer une origine fonctionnelle : brutalité des accès prurigineux, disparition du prurit quand l’attention du patient est focalisée par un événement ou une activité quelconque, pauvreté des lésions constatées à l’examen [6].
Traitement
Le traitement doit être simultanément étiologique (déjà évoqué ci-dessus), symptomatique et préventif.
De nombreuses publications générales sur le traitement du PA ont été publiées mais les recommandations reposent sur de faibles bases EBM. Très peu d’essais contrôlés du traitement du PA ont été publiés. Toutefois, les auteurs s’accordent tous sur un objectif principal du traitement : obtenir la région anale propre et sèche.
En pratique, certains points sont essentiels :
- l’élément psychologique, souvent important, rend très variable les réactions individuelles, d’où la nécessité d’un bon climat psychologique pour parvenir à un résultat valable et durable ;
- pour que l’observance du traitement soit optimale, des informations physiopathologiques plus ou moins détaillées, selon le niveau de compréhension et/ou de demande du patient, sont utiles ;
- la suppression de tous les traitements antérieurs et autres produits de toilette est recommandée d’emblée ;
- les principales règles hygiéno-diététiques non spécifiques, visant à obtenir la région anale propre et sèche, sont rapportées dans le Tableau II. Ces soins d’hygiène rendent à la zone son aspect antérieur en diminuant les lésions secondaires et permettent de mieux reconnaître les lésions spécifiques.
À la phase de dermite aiguë, il faut dans un premier temps assécher les lésions suintantes (nitrate d’argent aqueux 0,5 ou 1 %, permanganate de potassium à 1/20 000, éosine aqueuse à 2 %, fluorescéine à 1 %, solution de Milian) et protéger la peau par une pâte à l’eau (Aloplastine®) ou poreuse (Eryplast®), ou un gel fluide de Calamine® (contient de l’oxyde de zinc, du carbonate de zinc et de l’oxyde de fer) ou de Pruriced®. Le recours aux topiques à base de corticoïdes se fait uniquement si le traitement conservateur n’est pas efficace. Leur utilisation ne doit pas dépasser 4 à 6 semaines et les dermocorticoïdes faiblement dosés (hydrocortisone) doivent être privilégiés pour limiter les risques d’atrophie cutanée et les risques d’infection secondaire [29, 30].
À la phase chronique de lichénification, la stratégie thérapeutique n’est pas clairement codifiée. En effet, de nombreux traitements ont été proposés. On retiendra surtout :
Dermocorticoïdes en crème de classe 4 (Tableau I)
Ils doivent être administrés avec sevrage progressif sur 2 à 3 semaines au cours duquel il faut intercaler une crème topique à activité trophique ou protectrice (Cold cream naturelle Roche Posay®, Biafine®, Cicalfate® crème ou lotion, Cicadidé®, Cicaplast®, etc.) ou à base de zinc pour limiter les risques de cortico-dépendance.
Tableau II. Règles hygiéno-diététiques à respecter
en cas de prurit anal sans préjuger de l’étiologie

Antihistaminiques H1
Ils agissent davantage par leur effet sédatif que par leur effet antihistaminique si bien qu’il faut les prendre de préférence le soir (hydroxyzine, dexchlorpheniramine, etc.). Les antihistaminiques récents (desloratadine, levocetirizine…) sont moins sédatifs et peuvent donc être prescrits dans la journée.
En dernier recours, notamment en cas de prurit essentiel rebelle, certains ont proposé les traitements suivants :
Bleu de méthylène
Administré sous anesthésie générale, le bleu de méthylène à 0,5 % ou 1 % est injecté en intradermique ou en sous-cutané, souvent associé à un anesthésique local (type lidocaïne ou marcaïne) et de la cortisone. Il agirait par destruction des terminaisons nerveuses de la peau. Les suites immédiates sont souvent douloureuses et marquées par une hypoesthésie cutanée pendant 2 à 4 semaines mais l’efficacité peut être durable. Ce produit est contre-indiqué en cas de déficit en G6PD. Les complications graves sont exceptionnelles (ulcération, cellulite). Aucune antibioprophylaxie n’est recommandée. Une incontinence anale transitoire est possible [31-37].
Alcool, corticoïdes (acétate de méthylprednisolone) ou phénol à 5 % dilué dans de l’huile d’amande douce
Ils ont été proposés en injections intradermiques ou sous-cutanées [38, 39].
Capsaïcine
Alkaloïde naturel, composant chimique du feu du piment, elle a été utilisée en topique à 0,006 % avec un certain succès dans le PA idiopathique : 70 % d’amélioration pendant la phase de traitement, à raison de 3 applications/jour dans une étude, avec nécessité d’un traitement d’entretien chez presque tous les patients pour maintenir le résultat [40]. Elle agit en induisant le relargage complet des neuromédiateurs contenus dans terminaisons nerveuses cutanées. Elle n’a pas d’autorisation de mise sur le marché (AMM) en France dans cette indication. Le Zostrix® 0,025 % crème ou HP 0,075 %, seulement disponibles dans les pharmacies d’établissement de santé, ne peuvent être utilisés qu’avec une autorisation temporaire d’utilisation nominative. Une revue récente de la littérature souligne toutefois la nécessité d’autres études pour diffuser son utilisation [41].
Tacrolimus topique à 0,1 %
Dans un essai contrôlé randomisé contre placebo, il a montré une efficacité dans le PA essentiel dans environ 70 % des cas après 15 jours de traitement [42]. Une autre étude a également montré son efficacité dans le PA associé à une dermatite atopique [43]. L’effet est lié aux propriétés immunologiques du produit mais aussi à un effet similaire à celui de la capsaïcine. Il n’a pas l’AMM en France.
Cholestyramine en pommade à 5 % (préparation magistrale)
Elle a été utilisée avec succès dans certaines lésions anales induites par les diarrhées de même que les protéines de pomme de terre qui contiennent des inhibiteurs des protéases fécales, -lesquelles sont impliquées par leur -propriété protéolytique dans la genèse des dermites péri-anales des diarrhées [44, 45].
Crénothérapie
L’orientation vers les cures thermales utilisant les douches filiformes (La Roche Posay, Saint Gervais) peut être l’occasion d’une prise en charge plus personnalisée et n’a pas d’effet secondaire.
Hypnose
Elle s’est avérée efficace chez certains patients.
Antidépresseur
Il est parfois nécessaire. Il faut alors privilégier les antidépresseurs à forte action antihistaminique qui sont souvent aussi sédatifs : imipraminiques comme l’amitriptyline ou la doxepine, miansérine, etc. [6]. Une approche psychothérapique doit alors être associée.
Références
- Markell KW, Bilingham RP. Surg Clin N Am 2010;90:125-35.
- Zuccati G, Lotti T, Mastrolorenzo A, Rapaccini A, Tiradritti L. Pruritus ani. Dermatol Ther 2005;18:355-62.
- Siddiqi S, Vijay V, Ward M, Mahendran R, Warren S. Pruritus ani. Ann R Coll Surg Engl 2008;90:457-63.
- Song SG, Kim S-H. Priritus ani. J Korean Soc Coloproctol 2011;27:54-7.
- Stermer E, Shukhotonic I, Shaoui R. Pruritus ani: an approach to a itching condition. J Pediatr Gastroenterol Nutr 2009;48:513-6.
- Consoli S G. Prurit idiopathique. Encycl Méd Chir (Elsevier, Paris), AKOS Encyclopédie Pratique de Médecine, 6-0550, 1999, 3 p.
- Daniel G.L, Longo WE, Vernava AM III. Pruritus ani: causes and concerns. Dis Colon Rectum 1994;37:670-4.
- Dasan S, Neill SM, Donaldson DR, Scott HJ. Treatment of persistent pruritus ani in a combined colorectal and dermatological clinic. Br J Surg 1999;86:1337-40.
- Chaudhry V, Bastawrous A. Idiopathic pruritus ani. Semin Colon Rectal Surg 2003;14: 196-202.
- Hanno R, Murphy P. Pruritus ani. Classification and management. Dermatol Clin 1987;5: 811-6.
- Groupe de recherche en proctologie. Prévalence et retentissement des troubles de la défécation et de la continence dans la population française. Gastroenterol Clin Biol 2004;28:A122 (résumé).
- Bowyer A, McColl I. A study of 200 patients with pruritus ani. Proc R Soc Med 1970;63 (Suppl):96-8.
- Weichert GE. An approach to the treatment of anogenital pruritus. Dermatol Ther 2004;17:129-33.
- Schmelz M, Schmidt R, Bickel A, Handwerker HO, Torebjork HE. Specific C-receptors for itch in human skin. J Neurosci 1997;17: 8003-8.
- Caplan RM. The irritant role of feces in the genesis of perianal itch. Gastroenterology 1966;50:19-23.
- Smith LE, Henrichs D, McCullah RD. Prospective studies on the etiology and reatment of pruritus ani. Dis Colon Rectum 1982;25:358-63.
- Allan A, Ambrose NS, Silverman S, Keighley MR. Physiological study of pruritus ani. Br J Surg 1987;74:576-9.
- Eyers AA, Thomson JP. Pruritus ani: is anal sphincter dysfunction important in aetiology? BMJ 1979;2:1549-51.
- Farouk R, Duthie GS, Pryde A, Bartolo DC. Abnormal transient internal sphincter relaxation in idiopathic pruritus ani: physiological evidence from ambulatory monitoring. Br J Surg 1994;81:603-6.
- Anand P. Capsaicin and menthol in the treatment of itch and pain : recently cloned receptors provide the key. Gut 2003;52: 1233-5.
- Gordon PH, Nivatong S. Perianal dermatologic disease. In: Gordon PH, editor. Principles and practice of surgery for the colon, rectum and anus. 3rd édition. New York: informa Healthcare 2007:247-73.
- Dasan S, Neill SM, Donaldson DR, Scott HJ. Treatment of persistent pruritus ani in a combined colorectal and dermatological clinic. Br J Surg 1999;86:1337-40.
- Krânke B, Trummer M, Brabek E, Komericki P, Turek T-D, Aberer W. Etiologic and causative factors in perianal dermatitis: results of a prospective study in 126 patients. Wien Klin Wochenschr 2006;118:90-4.
- Mac Lean J, Russell D. Pruritus ani. Aust Fam Physician 2010;39:366-70.
- Awwad A, Renard P, Pouzoulet J, Sigal M-L, Mahé E. Anite érosive sous télaprévir. Ann Dermatol Venereol 2012;139:391-4.
- Hejna M, Valenckak J, Raderer M. Anal pruritus after cancer chemotherapy with gemcitabine. N Engl J Med 1999;340:656-7.
- Laurent A, Boucharlat J, Imbert R. Le prurit anal psychogène existe-t-il ? Bull Fr Col Proct 1995;2:18-20.
- Fellous K. Prurit anal. EMC (Elsvier SAS, Paris), Gastro-entérologie, 9-083-A-10, 2006.
- Al-Ghnaniem R, Short K, Pullen A, Fuller LC, Rennie JA, Leather AJ. 1% hydrocortisone oitment is an effective treatment of pruritus ani: a pilot randomized controlled crossover trial. Int J Colorectal Dis 2007;22:1463-7.
- Oztas MO, Oztas P, Onder M. Idiopathic perianal pruritus: washing compared with topical corticosteroids. Postgrad Med J 2004;80: 295-7.
- Eusebio EB, Graham J, Mody N. Treatment of intractable pruritus ani. Dis Colon Rectum 1990;33:770-2.
- Eusebio EB. New treatment of intractable pruritus ani. Dis Colon Rectum 1991;34:289.
- Botterill ID, Sagar PM. Intra-dermal methylene blue, hydrocortisone and lignocaine for chronic, intractable pruritus ani. Colorectal Dis 2002;4:144-6.
- Farouk R, Lee PW. Intradermal methylene blue injection for the treatment of intractable idiopathic pruritus ani. Br J Surg 1997;84:670.
- Mentes BB, Akin M, Leventoglu S, Gultekin FA, Oguz M. Intradermal methylene blue injection for the treatment of intractable idiopathic pruritus ani: results of 30 cases. Tech Coloproctol 2004;8:11-4.
- Sutherland AD, Farager G, Frizelle FA. Intradermal injection of methylene blue for the treatment of refractory pruritus ani. Colorectal Dis 2009;11:282-7.
- Samalavcius NE, Poskus T, Gupta RK, Lunevicius R. Long term results of intradermal 1% methylene blue injection for intractable idiopathic pruritus ani: a prospective study. Tech Coloproctol 2012;16:295-9.
- Tunuguntla A, Sullivan MJ. A new concept for the treatment of intractable pruritus ani. South Med J 2004;97:710.
- Shafik A. An injection technique for the treatment of idiopathic pruritus ani. Tech Coloproctol 2004;8:201.
- Lysy J, Sistiery-Ittah M, Israelit Y, Shmueli A, Strauss-Liviatan N, Mindrul V, Keret D, Goldin E. Topical capsaicin – a novel and effective treatment for idiopathic intractable pruritus ani: a randomised, placebo controlled, crossover study. Gut 2003;52 :1323-6.
- Gooding SMD, Canter PH, Coelho HF, Boddy K, Ernst E. Systematic revue of topical capsaicin in the treatment of pruritus. Int J Dermatol 2010;49:858-65.
- Suys E. Randomized study of topical tacrolimus ointment in the treatment for resistant pruritus ani. J Am Acad Dermatol 2012;66: 327-8.
- Ucak H, Demir B, Cicek D, Dertlioglu SB, Akkurt ZM, Ucmak D, Halisdemir N. Efficacity of topical tacrolimus for the treatment of persistent pruritus ani in patients with atopic dermatitis. J Dermatol Treat 2013;24:454-7.
- Ruseler-van Embden JG, van Lieshout LM, Smits SA, van Kessel I, Laman JD. Potato tuber proteins efficiently inhibit human faecal proteolytic activity: implications for treatment of peri-anal dermatitis. Eur J Clin Invest 2004;34:303-11.
- Berger S, Rufener J, Klimek P, Zachariou Z, Boillat C. Effect of poteto-derived protease inhibitors on perianal dermatitis after colon resection for long-segment Hirschsprung’s disease. World J Pediatr 2012;8:173-6.
Les Cinq points forts
-
Le prurit anal, symptome fréquent, peut être le témoin d’une affection proctologique, dermatologique ou plus rarement d’une pathologie générale, le diabète sucré en particulier.
-
Les principales causes sont liées aux suintements (hypocontinence, suppuration, hémorroïdes…), psoriasis, oxyurose.
-
Dans près de 50 % des cas, aucune cause n’est mise en évidence ; on parle alors de prurit anal essentiel où l’implication psychogène ne doit pas être automatique.
-
Le traitement du prurit anal est d’une part symptomatique (règles d’hygiène visant à obtenir la région anale sèche) et d’autre part étiologique.
-
Les dermo-corticoïdes permettent de briser le cercle vicieux : prurit anal – lésions cutanées – grattage ± surinfection.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION