Prise en charge diagnostique et thérapeutique des ulcères gastroduodénaux hémorragiques
Objectifs pédagogiques
- Connaître les risques de récidive liés à l’ulcère et au patient
- Les modalités du traitement médical, endoscopique et radiologique : quand, comment, les limites
- Prise en charge des patients à haut risque
- La surveillance post hémorragie : L’hospitalisation est-elle toujours nécessaire ?
Abréviations :
- UGD
- Ulcère Gastro Duodénal
- ESGE
- European Society of Gastrointestinal Endoscopy
- IPP
- Inhibiteurs de la Pompe à Protons
Introduction et épidémiologie
Les ulcères gastroduodénaux (UGD) hémorragiques sont la principale cause d’hémorragie digestive haute (définie par un saignement survenant en amont de l’angle de Treitz) en représentant environ 36 % des cas [1]. L’incidence des ulcères hémorragiques se situe entre 19,4 à 57 cas pour 100 000 habitants par an dans les pays européens et de 48 à 160 cas pour 100 000 habitants aux États-Unis [1, 2]. Bien qu’une diminution des hospitalisations pour UGD soit observée depuis quelques années, la mortalité reste stable entre 2,5 et 5,8 % [1].
La place de la chirurgie dans les ulcères gastroduodénaux hémorragiques est en nette diminution avec, au RoyaumeUni, le taux de recours à la chirurgie passantde8%à2%entre1993à2006; aux États-Unis , la chirurgie est également en baisse de 21 % au bénéfice du traitement endoscopie en augmentation de près de 60 % [1].
Ces données épidémiologiques se retrouvent dans l’étude récente coordonnée par l’association nationale des gastroentérologues des hôpitaux généraux (ANGH) entre mars 2005 et février 2006 qui incluait 3298 patients présentant une hémorragie digestive haute. L’UGD était le plus souvent en cause (38 % des cas), devant les hémorragies liées à l’hypertension portale (24,5 % des cas).
Diagnostic des UGD hémorragiques
Évaluation et prise en charge initiale
Devant toute hémorragie digestive, doivent être recherchés une déglobulisation aiguë et des troubles de coagulation avec un bilan biologique regroupant NFS et bilan de coagulation.
En cas d’anémie aiguë, le patient peut bénéficier de transfusion de culots globulaires. Le taux d’hémoglobine seuil est cependant controversé. Une étude récente a comparé une stratégie restrictive de transfusion pour une hémoglobine à 7 g/dl versus une stratégie de transfusion libre où l’objectif était un taux d’hémoglobine entre 9 et 11 g/dl3. Cette étude incluait toute cause d’hémorragies digestives : le groupe utilisant une stratégie transfusionnelle restrictive présentait un moindre taux de récidive hémorragique et une diminution de la mortalité. Dans le sous-groupe UGD hémorragique, seule une diminution de la mortalité était démontrée. Bien que ce soit une analyse en sous-groupe, les dernières recommandations européennes préconisent une stratégie transfusionnelle restrictive (objectif 7 g/dl) y compris dans les hémorragies sur UGD. Cette stratégie ne peut être appliquée qu’en l’absence d’anémie mal tolérée ou d’antécédents coronariens imposant l’obtention d’un taux d’hémoglobine plus élevé.
On peut donc retenir que la stratégie transfusionnelle dans les UGD hémorragiques devra avoir pour objectif un taux d’hémoglobine supérieur à 7 g/dl et supérieur à 10 g/dl en cas d’antécédents coronariens [3, 4].
En cas d’instabilité hémodynamique, le patient devra bénéficier d’un remplissage vasculaire par cristalloïdes afin de restaurer une volémie efficace de façon rapide [1, 2, 4, 5].
Endoscopie diagnostique : quand et comment ?
Afin de réaliser une endoscopie performante en terme diagnostique et éventuellement thérapeutique, l’utilisation d’accélérateurs de la vidange gastrique, principalement l’érythromycine (à la dose de 250 mg par voie intraveineuse sur 30 minutes 1 h avant l’endoscopie), est recommandée [1, 4–8]. Une étude récente rapporte que son utilisation permet une meilleure visualisation de la surface muqueuse entraînant une réduction de la nécessité de réaliser une seconde endoscopie. Les études sont cependant contradictoires quant à son effet sur le taux de culots globulaires transfusés, la durée d’hospitalisation ou le recours à la chirurgie. Il existe peu d’effets secondaires et ses principales contre-indications sont représentées par la présence d’un QT long et la sensibilité aux macrolides. L’ESGE recommande ainsi son utilisation chez les patients présentant une hémorragie active ou avec signes de gravité (instabilité hémodynamique principalement). Au contraire, la pose d’une SNG et l’utilisation de lavage gastrique n’a jamais prouvé son intérêt à visée diagnostique ou thérapeutique dans les différentes études décrites [4]. L’endoscopie digestive lors de la survenue d’hémorragie digestive haute doit être réalisée dans des conditions favorables, c’est-à-dire chez un patient stable sur le plan hémodynamique, intubé et ventilé de façon mécanique quand la situation l’exige (agitation, trouble de conscience ou hématémèses récidivantes).
Le délai de sa réalisation n’est pas précis dans la littérature : la plupart des études préconisent une FOGD dans les 24 h suivant l’extériorisation hémorragique. L’endoscopie peut cependant se faire de façon plus précoce dans les 6-12 h chez les patients restant instables ou présentant une hémorragie active continue afin de réaliser un geste hémostatique permettant un arrêt du saignement plus précoce [4, 6].
Traitement endoscopique
Afin d’assurer une endoscopie performante, il est nécessaire qu’elle soit réa-lisée par un gastro-entérologue formé à l’endoscopie digestive, assisté d’une infirmière spécialisée en endoscopie. Un endoscope vidéo idéalement à gros canal opérateur pour une meilleure aspiration et les outils d’hémostase endoscopique (clips, aiguille de sclérose, sonde thermique, voire poudre hémostatique) seront disponibles. La SFED a récemment publié un texte de recommandation pour le fonctionnement du plateau technique d’endoscopie digestive, et notamment la gestion endoscopique des hémorragies digestives (www.sfed.org).
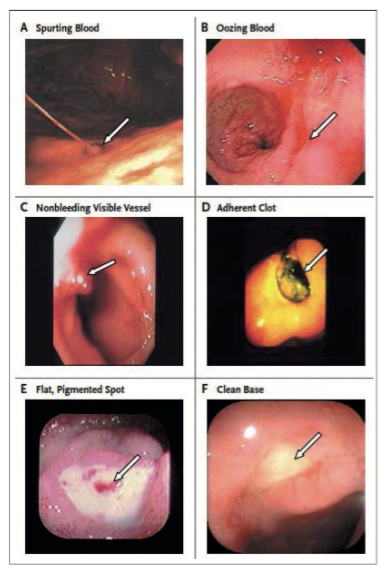
Les ulcères gastroduodénaux hémorragiques sont historiquement et au mieux classés selon la classification Forrest qui différencie les différents ulcères selon le risque de récidive hémorragique et le taux de mortalité : Forrest Ia saignement en jet, Forrest Ib saignement en nappe, IIa vaisseau visible non hémorragique, IIb caillot adhérent, IIc tache noire, III Fond propre (Fig. 1).
Le risque de récidive hémorragique en l’absence de traitement endoscopique variede55%pourlestadeIa,à5% pour ceux de stade III. Une étude récente confirme l’utilité de cette classification pour prédire le risque de réci
dive hémorragique avec une association plus forte pour les ulcères gastriques que pour les ulcères duodénaux. Cette étude montre l’intérêt d’une classification de Forrest modifiée, où les ulcères de type Ia seraient les seuls représentants de la catégorie « ulcères à hauts risques ». Les ulcères Ib, IIa,b,c seraient des « ulcères à risques augmentés » de récidive hémorragique et les ulcères stade III considéré comme à « bas risque de récidive » [9]. Ces données restent à confirmer et impliqueraient un sur-traitement endoscopiques des ulcères non hémorragiques.
Actuellement, le traitement endoscopique est indiqué pour les ulcères Forrest Ia à IIb afin de diminuer le taux de récidive hémorragique, la mortalité et le recours à la chirurgie [1, 2, 4, 6, 7].
En cas de caillot adhérent (Forrest IIb), il est recommandé de tenter de mobiliser le caillot autant que possible afin d’examiner précisément la lésion muqueuse sous-jacente et d’y cibler le traitement endoscopique [4]. En cas de caillot non mobilisable, l’attitude thérapeutique reste controversée mais il est recommandé de réaliser un geste hémostatique. En effet une méta-analyse parue dans Gastroenterology en 2005 montre une diminution de la réci-dive hémorragique par rapport au traitement médical seul [10]. Une étude coréenne récente confirme ce résultat et retrouve également une diminution du taux de mortalité globale [11].
Il est également admis que l’utilisation de 2 techniques endoscopiques dont une utilisant l’adrénaline diluée est plus performante que l’utilisation d’une seule technique [1, 4, 6].
L’injection sous muqueuse d’adrénaline diluée est la principale et la plus simple des techniques d’hémostase. C’est également la technique la plus étudiée dans le traitement hémostatique des ulcères gastroduodénaux hémorragiques. C’est une technique simple nécessitant peu de coordination entre l’endoscopiste et l’infirmière. Elle consiste à l’injection sous muqueuse d’adrénaline dilué 1/10 000e (1 mg d’adrénaline dans 10 cc de sérum physiologique) au niveau des 4 cadrans de l’ulcère. L’hémostase est obtenue par un effet mécanique dû au volume injecté associé à un effet vasoconstricteur propre à l’adrénaline. L’injection d’adrénaline va ainsi ralentir, voire arrêter, un saignement et permettre une meilleure visualisation de l’ulcère pour réaliser un second geste hémostatique.
Les clips métalliques hémostatiques permettent une hémostase mécanique par fermeture de l’ulcère ou d’un vaisseau hémorragique (Fig. 2). Le clip n’entraîne pas de lésion de la muqueuse, c’est une technique moins onéreuse que l’utilisation d’une sonde de coagulation. La mise en place d’un clip nécessite cependant une coordination plus précise entre l’endoscopiste et son assistant(e). Le clip peut être difficile à poser en cas de lésions fibreuses, d’ulcère trop large, ou de localisation difficile d’accès (cardia, petite courbure gastrique, genu superius). Les clips sont
Figure 2. Pose de clips sur un ulcère Forrest IIa duodénal
fréquemment utilisés en complément de l’adrénaline diluée.
La coagulation thermique des ulcères hémorragiques est une technique d’hémostase ancienne dont l’utilisation est maintenant devenue marginale. Le principe est l’utilisation d’un outil d’endothérapie branché à un bistouri électrique pour coaguler la lésion hémorragique. Le risque de complication propre à cette technique, notamment les perforations d’ulcères, n’est pas nul. Il existe des sondes hybrides (Gold Probe®, Boston Scientific) permettant avec un seul outil d’endothérapie une injection d’adrénaline diluée et une thermocoagulation.
Une grande nouveauté pour le traitement des hémorragies actives est la disponibilité depuis peu de poudres hémostatiques (Fig. 3). Hemospray® (Cook Medical) est une poudre inerte aux propriétés absorbantes qui, lorsqu’elle est en contact avec le sang, permet la formation d’un coagulum permettant de créer un obstacle mécanique. Elle absorbe le sérum permettant une augmentation locale du taux de facteur coagulation et de plaquettes. L’indication repose sur les hémorragies digestives hautes non variqueuses et actives. Elle est utile lorsque la pose de clips est impossible (saignement diffus abondant) ou inefficace afin de réaliser une hémostase de « sauvetage ». Elle permet d’obtenir l’arrêt du saignement dans plus de 90 % des cas rapportés dans la littérature disponible.
Le clip OTSC® (Ovesco, Allemagne) est un gros clip monté sur un capuchon au bout de l’endoscope. Il a été développé et commercialisé pour le traitement endoscopique des fistules et des hémorragies digestives réfractaires. Son efficacité dans des saignements actifs gastroduodénaux sévères est rapportée dans la littérature. En pra-tique, son coût élevé, la relative technicité de mise en place de ce clip et l’existence d’alternatives accessibles en font un outil d’utilisation très marginale dans cette indication.

Figure 2. Pose de clips sur un ulcère Forrest IIa duodénal

Figure 3. Application d’Hemospray® sur ulcère duodénal hémorragique
Prise en charge post-endoscopique
Traitement médical
À la phase aiguë
Le traitement médical consiste en un traitement par inhibiteurs de pompe à protons (IPP) à haute dose par voie intraveineuse (bolus 80 mg suivi d’une perfusion continue de 8 mg/h pendant 72 h) notamment chez les patients des UGD à haut risque de récidive (Forrest I et IIa et IIb) ayant bénéficié d’un geste hémostatique ou pour les ulcères avec caillots adhérents n’ayant pas bénéficié de gestes [4]. Cette stratégie thérapeutique permet de réduire la récidive hémorragique, le recours à la chirurgie et le taux de mortalité chez cette catégorie de patients. Les IPP doivent être mis en place dès la suspicion d’hémorragie digestive haute sur ulcères peptiques et ne doit pas retarder l’endoscopie digestive haute. L’utilisation précoce des IPP avant l’endoscopie permettrait, selon une méta-analyse récente, une réduction du taux d’ulcères à haut risque de resaignement, une tendance à la diminution d’indication d’hémostase endoscopique et serait coût/efficace [12]. Aucun effet n’est cependant visualisé en ce qui concerne la récidive hémorragique, le recours à la chirurgie ou la mortalité.
La dose d’IPP est cependant controversée. On notera sur les études récentes qu’une stratégie peut être envisagée avec l’utilisation d’IPP à double dose pendant 72 h suivant le bolus de 80 mg (en remplacement de la perfusion continue) avec une efficacité qui serait similaire chez la même catégorie de patient, mais ces données viennent d’études hétérogènes et nécessitent une confirmation par des études complémentaires [4].
Chez les patients présentant un ulcère à faible risque hémorragique (IIc et III) un traitement IPP simple dose (40 mg/j) est suffisant [4].
La somatostatine, l’octréotide ainsi que l’acide tranexamique (Exacyl®) n’ont pas prouvé leur efficacité dans le traitement des UGD hémorragiques [4, 6].
Gestion des IPP à distance
En cas d’ulcère gastro-duodénal hémorragique lié à Helicobacter pylori, le traitement par IPP pleine dose sera poursuivi 3 à 7 semaines pour cicatrisation. L’endoscopie de contrôle sera systématique pour les biopsies de la cicatrice de l’ulcère gastrique et les biopsies de contrôle après éradication d’Helicobac ter pylori.
Gestion des anticoagulants et antiagrégants
UGD et anticoagulation efficace
Les ulcères gastroduodénaux hémorragiques sont la complication hémorragique la plus fréquente chez les patients sous anticoagulation curative notamment sous AVK. En cas d’instabilité hémodynamique ou d’hémorragie sévère, une réversion des AVK doit être réalisée en accord avec l’équipe de cardiologie (par utilisation de vitamine K, PPSB ou PFC). Si cela est possible, un INR < 2,5 devra être obtenu avant la réalisation de l’endoscopie digestive. La reprise des AVK ne doit être réalisée si possible au-delà du 7e jour sauf si risque thrombotique majeur [4].
Concernant les nouveaux anticoagulants, l’ESGE recommande un arrêt des traitements si possible après discussion avec l’équipe de cardiologie et après avoir pris connaissance du type de médicament et son dosage, de l’heure de la dernière prise et de la fonction rénale. Du fait de l’absence de test en routine pouvant évaluer le niveau réel d’anticoagulation et des difficultés de réversion, la prise en charge dépendra de la gravité du saignement et des possibilités de traitement endoscopique sachant que des antidotes seront très prochainement disponibles et indiqués en cas de saignement incontrôlable.
UGD et antiagrégants plaquettaires
Concernant la gestion des antiagrégants, l’ESGE préconise une stratégie de prise en charge différente selon le risque de récidive et l’indication de l’anti-agrégation [4].
En cas d’ulcère à haut risque (I, IIa, IIb)
Si le traitement était indiqué en prophylaxie primaire, il est nécessaire de suspendre le traitement par aspirine pendant l’événement aigu et de réévaluer la balance bénéfice/risque de celui-ci. Il pourra, s’il est nécessaire, être repris à la cicatrisation de l’ulcère.
Si le traitement était indiqué en prophylaxie secondaire, le traitement par aspirine devra être repris à faible dose à J3 de la FOGD initiale. Si le patient bénéficie d’une double anti agrégation plaquettaire, seule l’aspirine à faible dose sera poursuivie et une consultation cardiologique devra être prévue rapidement.
En cas d’ulcère à bas risque (IIc, III)
Si le traitement était indiqué en prophylaxie primaire, le traitement sera suspendu et réévalué après évaluation de la balance bénéfice-risque. Si nécessaire, il sera repris à la sortie d’hospitalisation.
Si le traitement était indiqué en prophylaxie secondaire, la double antiagrégation pourra être poursuivie.
Prise en charge d’Helicobacter Pylori
Afin de prévenir la récidive ulcéreuse, il est nécessaire de diagnostiquer et de traiter les ulcères liés à Helicobacter pylori. Cependant dans le contexte hémorragique, l’apport de l’histologie est moindre du fait d’un risque plus élevé de faux négatif ou de biopsies gastriques non réalisables du fait de l’hémorragie digestive elle-même. La sérologie peut donc permettre de faire le diagnostic ou les biopsies peuvent être réalisées à distance de l’épisode hémorragique lors d’une endoscopie de contrôle. Si la recherche est positive, il sera nécessaire d’éradiquer Helicobacter pylori par antibiothérapie et son éradication devra être vérifiée au mieux par biopsies gastriques de contrôle.
Alimentation
Les malades présentant une hémorragie digestive sur UGD sont initialement soumis à une diète stricte. Apres un geste endoscopique efficace ils peuvent reprendre un régime liquide
puis progressivement un régime normal au-delà de 48 à 72 h. Chez les patients présentant un ulcère à bas risque l’alimentation peut être reprise normalement [4].
Des études récentes avec des effectifs de petites tailles ne montrent pas d’effets négatifs notamment sur le taux de récidive hémorragique de la réalimentation précoce. Ces études restent à être confirmés et permettraient une réduction de la durée l’hospitalisation et les complications liés à la dénutrition chez les patients fragiles [1, 3].
Risque récidive et « 2nd look » endoscopique
Il est nécessaire de stratifier les patients présentant une hémorragie digestive haute sur ulcère gastroduodénal en groupe à haut risque et groupe à bas risque afin d’adapter la prise en charge et d’évaluer le risque de mortalité [2, 4].
Deux scores pronostiques sont historiques mais restent peu utilisés en pratique (Fig. 4) :
– le score de Rockall : pouvant être réalisé avant et après endoscopie, ce score prend en considération des critères cliniques et endoscopiques pour évaluer le risque de récidive et surtout évaluer le taux de mortalité ;
– le score de Glasgow-Blatchford : principalement utilisé pour décider de l’orientation et de la réalisation de l’endoscopie. Ce score serait plus efficace que le score Rockall et plus utile en pratique.
Le risque de récidive globale est de 10 % après une hémorragie digestive haute [1]. IL est donc utile d’en connaître les facteurs déterminants pour adapter la prise en charge.
Ces facteurs de risques peuvent être répartis en deux groupes : d’une part les caractéristiques de l’ulcère avec sa localisation au niveau de la face postérieure du bulbe, petite courbure gastrique (souvent difficile d’accès pour un geste endoscopique de qualité), sa taille > 2 cm, la présence d’un saignement actif au moment de l’endoscopie ; d’autre part les facteurs de risques liés aux patients avec l’instabilité hémodynamique principalement [14–16]. La place du taux d’hémoglobine et les transfusions de culot globulaire restent quant à elles peu certainse. Une étude récente réalisée en 2015 chez les UGD à haut risque de récidive (Forrest I, IIa et IIb) retrouve comme facteurs de risques la consommation d’AINS, la transfusion d’au moins 5 unités de culots globulaires et l’absence d’endoscopie de contrôle [17] (Fig. 5).
La place de l’endoscopie de contrôle précoce 24 h systématique (dit endoscopie de « second look »), au décours de la prise en charge initiale, est controversée d’autant que cette stratégie n’est pas coût/efficace. Les différentes études ayant étudié cet aspect retrouvaient une réduction modérée du taux de mortalité et du recours à la chirurgie sans impact sur la mortalité [1, 4, 6]. Cependant ces différentes études n’utilisaient pas le traitement médical adéquat par IPP par voie intraveineuse continue. L’étude coréenne de 2015 retrouve comme facteur de risque de récidive l’absence de second look chez les patients présentant un ulcère hémorragique à haut risque de récidive selon la classification de Forrest [17].
Il semble raisonnable de proposer une endoscopie de contrôle lorsque l’endoscopie initiale s’est révélée sous optimale, soit du fait de son déroulement dans des conditions d’urgence, soit parce que le geste endoscopique effectué n’est pas satisfaisant. La présence d’ulcères à haut risque de récidive (surtout si traitement anticoagulant ou antiagrégant en cours) peuvent être également une indication de FOGD de contrôle.
Hospitalisation
Les patients présentant une hémorragie digestive grave (avec instabilité hémodynamique, déglobulisation aiguë massive, comorbidités importantes, trouble de coagulation important, hémorragie active continue) doivent être hospitalisés dans un service de soins intensifs ou de réanimation pour surveillance continue et prise en charge adaptée pendant les 72 premières heures [4].
En l’absence de critères de gravité, le patient peut être hospitalisé en service de médecine et la sortie peut être envisagée dans les 48 h en l’absence de récidive.
Certaines hémorragies digestives pourraient être prises en charge en ambulatoire avec réalisation d’une endoscopie en externe afin de réduire les taux d’hospitalisation et donc des coûts. C’est notamment en utilisant un score de Glasgow-Blatchford à 0 que les différentes études ont pu conclure à l’absence de risque à une prise en charge en externe [4, 18, 19]. Une étude américaine parue en 2015 préconiserait d’augmenter le seuil du score de Glasgow-Blatchford à 1 pour la prise en charge non hospitalière des UGD hémorragiques mais ces données restent à confirmer [20].
Prise en charge de l’échec du traitement endoscopique
1 per-endoscopique
En cas d’échec primaire endoscopique, la prise en charge peut consister en une embolisation radiologique ou un traitement chirurgical. Le choix entre les deux techniques dépend de la localisation de l’ulcère, de la faisabilité de l’embolisation et des comorbidités pouvant induire une morbidité post-opératoire plus i
2 récidive
En cas de récidive hémorragique, une nouvelle tentative d’hémostase endoscopique doit être le plus souvent tentée. Cependant dans les cas où le traitement endoscopique semblait complexe dès la première endoscopique (ulcère large, localisation difficile…) le traitement par chirurgie ou radio-embolisation pourra être proposé d’emblée [1, 2, 4, 21].
L’embolisation radiologique a un taux plus élevé de récidive hémorragique et d’échec mais moins de comorbidités post procédure par rapport au traitement chirurgical qui ne présente que peu d’échecs sur le plan de la récidive hémorragique mais qui n’est pas dénué de morbi-mortalité. Aucune étude n’a comparé l’embolisation à la chirurgie.
Conclusion
L’hémorragie digestive ulcéreuse est la plus fréquente des urgences en endoscopie digestive. La prise en charge repose sur la mise en route dès le diagnostic évoqué d’une perfusion d’inhibiteurs de la pompe à protons. L’endoscopie haute doit être réalisée aussi rapidement que possible dans les meilleures conditions techniques. Deux techniques combinées d’hémostase endoscopique, le plus souvent par injection d’adrénaline diluée et la mise en place de clips, permettent l’hémostase dans la plupart des situations. En cas d’échec, une nouvelle endoscopie peut être proposée, notamment grâce aux nouveaux outils endoscopiques comme les poudres hémostatiques. La chirurgie et la radiologie interventionnelle ont une place en traitement de seconde, voire de troisième ligne.
Les Cinq points forts
- Le traitement médical par IPP doit être débuté dès le diagnostic évoqué : IPP 80 mg en bolus puis 8 mg/h.
- L’endoscopie haute doit être réalisée dans les meilleures conditions techniques possibles, dans les 24 premières heures sauf défaillance hémodynamique.
- Un traitement endoscopique efficace doit comporter deux gestes d’hémostase combinés.
- Un traitement antiagrégant plaquettaire en prévention secondaire ne doit pas être interrompu au delà de 72 heures.
- Une endoscopie de contrôle précoce doit être proposée en cas d’hémostase initiale non satisfaisante et d’ulcère à haut risque de récidive.
- En cas d’hémorragie non contrôlable par endoscopie, une embolisation ou à défaut une chirurgie doit être envisagée dans les meilleurs délai.
Références
- Lau JYW, et al. Challenges in the management of acute peptic ulcer bleeding. Lancet Lond Engl 2013;381:2033-43.
- Gralnek IM, Barkun AN, Bardou M. Management of acute bleeding from a peptic ulcer. N Engl J Med 2008;359:928-37.
- Villanueva C, et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013;368:11-21.
- Gralnek IM, et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015;47:a1-a46.
- LaineL,JensenDM.Managementofpatients with ulcer bleeding. Am. J. Gastroenterol 2012;107:345-60; quiz 361.
- Kim J., Park SM, Kim B-W. Endoscopic management of peptic ulcer bleeding. Clin Endosc 2015;48:106-11.
- Kim KB, Yoon SM, Youn SJ. Endoscopy for nonvariceal upper gastrointestinal bleeding. Clin Endosc 2014;47:315-19.
- Wong SH, Sung JJY. Management of GI emergencies: peptic ulcer acute bleeding. Best Pract. Res Clin Gastroenterol 2013;27:639-47.
- de Groot NL, et al. Reassessment of the predictive value of the Forrest classification for peptic ulcer rebleeding and mortality: can classification be simplified? Endoscopy 2014;46:46-52.
- Kahi CJ, et al. Endoscopic therapy versus medical therapy for bleeding peptic ulcer with adherent clot: a meta-analysis. Gastroenterology 2005;129:855-62.
- Kim SH, et al. [Comparison between Endoscopic Therapy and Medical Therapy in Peptic Ulcer Patients with Adherent Clot: A Multicenter Prospective Observational Cohort Study]. Korean J Gastroenterol Taehan Sohwagi Hakhoe Chi 2015;66:98-105.
- Sreedharan A, et al. Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in upper gastrointestinal bleeding.
Cochrane Database Syst Rev CD005415 (2010). doi:10.1002/14651858.CD005415.pub3 - Khoshbaten M, Ghaffarifar S., Jabbar Imani A, Shahnazi T. Effects of early oral feeding on relapse and symptoms of upper gastrointestinal bleeding in peptic ulcer disease. Dig Endosc. Off. J. Jpn. Gastroenterol. Endosc Soc 2013;25:125-9.
- Elmunzer BJ, Young SD, Inadomi JM, Schoenfeld P, Laine L. Systematic review of the predictors of recurrent hemorrhage after endoscopic hemostatic therapy for bleeding peptic ulcers. Am J Gastroenterol 2008;103:2625-32; quiz 2633.
- García-Iglesias P, et al. Meta-analysis: predictors of rebleeding after endoscopic treatment for bleeding peptic ulcer. Aliment Pharmacol Ther 2011;34:888-900.
- Maggio, D. et al. Predictors of early rebleeding after endoscopic therapy in patients with nonvariceal upper gastrointestinal bleeding secondary to high-risk lesions. Can J Gastroenterol J Can Gastroenterol 2013;27:454-8.
- Kim SB, et al. Risk Factors Associated with Rebleeding in Patients with High Risk Peptic Ulcer Bleeding: Focusing on the Role of Second Look Endoscopy. Dig. Dis. Sci. (2015). doi:10.1007/s10620-015-3846-y
- Girardin M, et al. Use of glasgow-blatchford bleeding score reduces hospital stay duration and costs for patients with low-risk upper GI bleeding. Endosc. Int. Open 2014;2:E74–79.
- StanleyAJ,etal.Outpatientmanagementof patients with low-risk upper-gastrointestinal haemorrhage: multicentre validation and prospective evaluation. Lancet Lond Engl 2009;373:42-7.
- Laursen SB, et al. Performance of new thresholds of the Glasgow Blatchford score in managing patients with upper gastrointestinal bleeding. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc 2015;13:115-121.e2.
- Laursen SB, Jakobsen M, Nielsen MM, Hovendal C, Schaffalitzky de Muckadell OB. Transcatheter arterial embolization is the first-line therapy of choice in peptic ulcer bleeding not responding to endoscopic therapy. Scand J Gastroenterol 2015;50:264-71.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION