Ascite non cirrhotique
Objectifs pédagogiques
- Connaître les étiologies de l’ascite non cirrhotique
- Stratégie diagnostique
- Connaître les stratégies thérapeutiques
Introduction
L’ascite est un épanchement libre dans la cavité péritonéale qui est dans la majorité des cas liée à une cirrhose dont le diagnostic est aisé. Cependant, la présence d’une cirrhose n’est pas une condition exclusive et une ascite peut apparaître dans d’autres situations pathologiques dont le diagnostic et la stratégie thérapeutique sont moins bien codifiés. On peut distinguer 2 types d’ascite non cirrhotique, celle liée à une atteinte du péritoine lui-même (infection, carcinose, ou sérite) qui est à différencier de celle sans atteinte péritonéale mais secondaire à une hypertension portale non cirrhotique qui regroupe des pathologies essentiellement vasculaires ou lymphatiques (Tableau I).

Tableau I. Maladies associée à l’ascite non cirrhotique
Stratégie diagnostique
L’examen clinique avec augmentation du périmètre abdominal et matité des flancs est présente pour une ascite de plus de 1 litre alors que pour des ascites de plus faible volume, c’est en général l’échographie qui permettra le diagnostic. Les ascites liées à une cirrhose ne sont pas abordées dans ce texte. Pour les ascites non cirrhotiques, le contexte de survenue comme une tuberculose ou une connectivite déjà connue donne un élément d’orientation. La présence de signes généraux comme une fièvre ou un syndrome inflammatoire biologique peuvent orienter le clinicien vers certaines étiologies néoplasiques ou infectieuses.
Un examen radiologique de base par échographie ou le plus souvent par un scanner permet de visualiser le péritoine, les organes digestifs, les veines sus-hépatiques et la veine porte. Les coupes thoraciques permettent de rechercher une atteinte extra-digestive comme une tuberculose ou une sarcoïdose.
La ponction d’ascite quelle qu’en soit la méthode (ponction à l’aveugle ou bien écho-guidée) est l’élément clef permettant une orientation diagnostique. L’aspect macroscopique est à prendre en compte puisqu’en général l’ascite est de couleur jaune pâle alors qu’un aspect laiteux orientera vers une ascite chyleuse riche en triglycérides ou en chylomicrons. Une ascite spontanément hémorragique est suspecte d’être carcinomateuse (Tableau II).
Le péritoine est une barrière qui va réguler les échanges en fonction de la pression hydrostatique et de la pression oncotique des protéines. La composition du liquide d’ascite est donc fonction de la pression veineuse dans le territoire portal mais également lymphatique ainsi que par la capacité de sécrétion ou de résorption du tissu péritonéal lui-même [1]. L’analyse du liquide d’ascite donne ainsi une orientation générale et des pistes étiologiques qui sont résumées dans le Tableau II.
Analyse biochimique du liquide d’ascite
Il faut obligatoirement déterminer la concentration en protéines du liquide d’ascite qui est mise en perspective avec la concentration en albumine du sérum, permettant de définir le gradient protéique sérum-ascite [2]. On considère qu’une ascite est pauvre en protides pour des valeurs inférieures à 25 g/L qui historiquement permettaient de différencier les transsudats des exsudats.
Le gradient albumine sérique-albumine dans l’ascite est plus discriminant et on considère que lorsque ce gradient est > 11 g/L, il s’agit dans la majorité des cas d’une ascite secondaire à une hypertension portale et plus rarement à une dénutrition protéique sévère. À l’inverse lorsque ce gradient est < 11 g/L une hypertension portale est peu probable et il s’agit dans la majorité des cas d’une tuberculose, d’une carcinose ou d’une autre cause [2–4].
Des analyses biochimiques complémentaires [1, 2] sont utiles dans certaines situations (Tableau II). En cas d’ascite d’aspect laiteux, l’élévation du taux des triglycérides dans le liquide permet de confirmer le caractère chyleux de l’ascite. L’augmentation dans l’ascite du taux de cholestérol avec un seuil de 1,8 mmol/l ou des LDH par rapport à la concentration sérique est fréquente en cas de néoplasie avec une sensibilité de 90 % mais avec une mauvaise spécificité [4]. Le dosage de l’adénosine désaminase [5], lorsque son taux est élevé (> 21 à 30 UI/L) dans le liquide d’ascite, est un élément d’orientation vers une tuberculose péritonéale [5]. La sensibilité de ce marqueur serait de 90 à 100 % avec une spécificité de 80 à 97 %. Cependant, en cas de cirrhose, la sensibilité de l’augmentation de l’adénosine désaminase n’est que de 30 % [6]. De manière anecdotique, une forte augmentation du taux d’amylase dans l’ascite peut orienter vers une fistule pancréatique. L’analyse de marqueurs tumoraux comme le CA125 ou le CA19–9 dans l’ascite n’ont pas une sensibilité ou de spécificité suffisante pour pouvoir être recommandée.

Tableau II. Caractéristiques de l’ascite en fonctions des maladies associées
Analyse cytologique et microbiologique de l’ascite
L’analyse cytologique du liquide d’ascite doit être systématique en cas d’ascite non cirrhotique. La ponction doit être de volume suffisant pour pouvoir permettre une analyse immuno-histochimique d’éventuelles cellules carcinomateuses. Une ascite lymphocytaire est un élément d’orientation vers une hémopathie lymphoïde ou une tuberculose alors qu’une ascite riche en polynucléaires neutrophiles est en faveur d’une infection péritonéale bactérienne avec un seuil de 250 polynucléaires neutrophiles/mm3 [7]. L’étude immuno-histochimique permet de caractériser les cellules carcinomateuses en n’hésitant pas à multiplier les ponctions d’ascite en cas de prélèvement initial négatif. L’analyse cytologique à la recherche de cellules carcinomateuses a une sensibilité qui est variable de 50 % à 97 % en fonction des équipes [7]. Une cœlioscopie diagnostique avec biopsies péritonéales n’est réalisée qu’en deuxième intention si le diagnostic reste incertain.
Le liquide d’ascite est envoyé pour analyse microbiologique et culture au laboratoire de bactériologie, mycobactériologie et éventuellement en parasitologie-mycologie chez les patients immunodéprimés.
Étiologie des ascites non cirrhotiques
Gradient albumine sérum-ascite bas < 11 g/L
Carcinose péritonéale
Même si le gradient sérum-ascite est bas, il s’agit dans la majorité des cas d’une ascite riche en protéines > 25 g/L. En cas d’ascite maligne, la physiopathologie de l’ascite est multifactorielle avec une augmentation de la perméabilité vasculaire et une obstruction du drainage lymphatique [7]. Cette augmentation de la perméabilité capillaire est favorisée par certaines cytokines comme le VEGF. Les cancers les plus fréquemment observés sont gynécologiques et en particulier ovarien mais également colorectal ou pancréatique [10]. À la différence des cancers solides, les ascites lymphomateuses sont plus rares. Une tumeur primitive péritonéale comme le mésothéliome est exceptionnelle avec une rentabilité diagnostique de la ponction d’ascite qui est moins bonne (< 40 %) que celle des carcinoses péritonéales sur cancer solide. Le scanner oriente le diagnostic (Fig. 1). L’augmentation de la mésothéline dans le liquide d’ascite a une sensibilité de 67 % et ne remplace pas l’analyse anatomopathologique. En cas de suspicion de mésothéliome, il faut avoir recours à la chirurgie cœlioscopique pour réaliser des biopsies péritonéales permettant un diagnostic de certitude [11]. La possibilité d’une exceptionnelle maladie gélatineuse du péritoine est évoquée devant une ascite récidivante riche en mucine avec une tumeur le plus souvent appendiculaire ou ovarienne [7].

Figure 1. Mésothéliome avec infiltration tissulaire sur la coupe axiale (flèche) – la reconstruction coronale montre un foie non dysmorphique (collection Pr Otal, Radiologie CHU Rangueil Toulouse)
Tuberculose péritonéale
Il s’agit d’un liquide riche en lymphocytes et avec un taux de protéine dans l’ascite > 25 g et un gradient albumine sérum-ascite est < 11 g/L. Le diagnostic est évoqué sur le contexte clinique et épidémiologique : un contact ou un séjour en zone d’endémie tuberculeuse associé à une altération de l’état général. Seulement 38 % des patients ont une tuberculose pulmonaire [8]. L’IDR ou le quantiféron ne sont positifs que dans 50 % à 80 % des cas [8, 9]. Le diagnostic est confirmé par la recherche à l’examen direct, en culture et par PCR de la mycobactérie. À l’examen direct, la mycobactérie est mise en évidence dans moins de 6 % des cas alors que la culture n’est positive que chez 20 à 35 % des malades [8, 9]. Le diagnostic par PCR a l’avantage de pouvoir être réalisé sur un volume faible avec un résultat plus rapide mais là-aussi avec une sensibilité insuffisante de 60 à 80 %. La valeur prédictive de la positivité du Quantiféron dans le liquide d’ascite pourrait être intéressante mais reste non validée [6]. En cas de négativité des examens microbiologiques avec une forte suspicion clinique, le diagnostic est fait par un abord chirurgical cœlioscopique mettant en évidence sur le péritoine les granulomes avec nécrose caséeuse dont la sensibilité est excellente > 95 % [8, 9].
Bloc sus-hépatique
Que ce soit le syndrome de Budd-chiari par obstruction des veines sus hépatiques (Fig. 2) ou par insuffisance cardiaque droite, l’ascite est en général riche en protides. Le syndrome de Budd-chiari doit faire réaliser un bilan d’une thrombophilie constitutionnelle ou acquise. Une ascite liée à une insuffisance cardiaque droite peut survenir au cours d’une cardiopathie aiguë ou chronique et doit faire éliminer une péricardite constrictive ou une embolie pulmonaire massive. Les explorations radiologiques des veines sus hépatiques et cardiologiques par cathétérisme droit permettent de confirmer le diagnostic.

Figure 2. Foie de contours réguliers avec un macro-nodule d’hyperplasie nodulaire régénérative (collection Pr Otal, Radiologie CHU Rangueil Toulouse)
Ascite chyleuse
Il s’agit d’une ascite riche en triglycérides avec une concentration dans l’ascite > 2 g/L. Elle est suspectée par l’aspect macroscopique blanchâtre ou laiteux du liquide d’ascite riche en protides [4]. La première cause est liée à un traumatisme chirurgical du canal lymphatique, en particulier en chirurgie urologique ou vasculaire abdominale [12]. Plus rarement, il s’agit d’une atteinte ganglionnaire d’un lymphome et exceptionnellement d’une maladie congénitale par dysplasie des canaux lymphatiques ou par une infection parasitaire à filaires après un séjour en zone d’endémie.
Maladie dysimminutaire
Les connectivites peuvent s’associer à une ascite qui est en général riche en protides et secondaire à une sérite par vascularite péritonéale en particulier pour le lupus systémique [4]. Une connectivite est à différencier d’une atteinte péritonéale d’un syndrome hyper éosinophilique ou le taux d’éosinophiles sanguins est très élevé avec une ascite également riche en éosinophiles. En cas de syndrome néphrotique au cours d’un lupus ou d’une amylose, l’ascite s’intègre dans une anasarque liée à une hypoalbuminémie majeure avec protéinurie élevée.
Gradient albumine sérum-ascite élevé > 11 g/L
Il s’agit le plus souvent d’une maladie vasculaire du foie avec une hypertension portale non cirrhotique [13]. De multiples maladies vasculaires du foie sont associées à une hypertension portale non liée à la cirrhose (Tableau III). En effet chez le patient cirrhotique, le gradient porto-sus hépatique > 5 mm/Hg est lié à l’augmentation de la résistance sinusoïdale alors que dans l’hypertension portale non cirrhotique, le gradient porto sus-hépatique est le plus souvent normal ou très modérément élevé avec une pression dans la veine porte qui est normale. L’hypertension portale non cirrhotique inclut des maladies vasculaires diverses dont la classification dépend du siège de l’augmentation des résistances vasculaires qui peut être sinusoïdale, pré-sinusoïdale ou plus rarement post-sinusoïdale (Tableau III). L’imagerie par scanner peut donner un élément d’orientation en précisant le caractère homogène ou nodulaire du foie (Fig. 2) et la perméabilité des veines sus hépatiques ou du tronc porte (Fig. 3).

Tableau III. Causes de l’hypertension portale non cirrhotique

Figure 3. Syndrome de Budd Chiari à la phase aiguë – foie congestif, augmenté de volume. Les 3 veines sus hépatiques sont thrombosées simultanément.
Sur la reconstruction coronale, on ne visualise que les veines moyenne et gauche (collection Pr Otal, Radiologie CHU Rangueil Toulouse)
Le diagnostic d’hypertension portale non cirrhotique repose sur les critères de Schouten et al. [14] associant les points suivants : splénomégalie et hypersplénisme, varices œsophagiennes, ascite, augmentation du gradient porto-sus-hépatique, circulation collatérale, exclusion de la cirrhose sur la biopsie hépatique, exclusion des autres causes de maladie hépatique (virale stéato-hépatite, hépatite auto-immune, hémochromatose, maladie de Wilson ou cirrhose biliaire primitive), exclusion des autres causes d’hypertension portale non cirrhotique (fibrose hépatique congénitale, la sarcoïdose ou la bilharziose), perméabilité des veines sus hépatiques et de la veine porte par imagerie de type écho-doppler ou scanner.
Les causes d’hypertension portale non cirrhotique en fonction de la localisation du bloc pré-sinusoïdal, sinusoïdal ou post-sinusoïdal sont résumées dans le tableau 3. Les complications de l’hypertension portale non cirrhotique sont dominées par les hémorragies digestives par rupture de varices alors que l’ascite n’est présente que dans 10 à 34 % des cas [13-14]. Le diagnostic est porté par l’étude hémodynamique et surtout par la biopsie hépatique. Le diagnostic anatomopathologique est souvent difficile et nécessite un prélèvement de taille suffisante [15]. Le dialogue avec l’anatomopathologiste est très important et permet de préciser l’atteinte vasculaire et la présence éventuelle d’une hyperplasie nodulaire régénérative avec transformation nodulaire du parenchyme hépatique en l’absence de fibrose extensive péri-nodulaire (Fig. 4).

Figure 4. Hyperplasie nodulaire régénérative avec une fibrose portale faible, des images focales de fibrose des veines centro lodulaire et une nodulation hépatocytaire (collection Pr Selves, anatomopathologie CHU Toulouse)
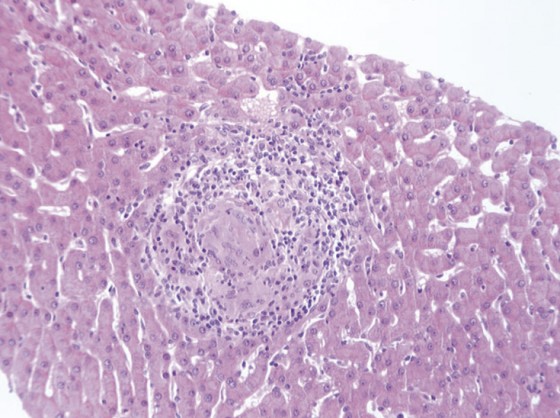
Figure 5. Coupe anatomopathologique
d’une hépatite granulomateuse
révélant une sarcoïdose
Dans certains cas, le diagnostic de la cause de l’hypertension portale non cirrhotique peut être très difficile ou révéler une pathologie inattendue (Fig. 5).
Prise en charge thérapeutique
Le traitement de l’ascite non cirrhotique dépend du contexte étiologique. Les diurétiques lorsqu’ils sont utilisés seuls sans traitement de la maladie causale sont en général peu efficaces. En cas de carcinose péritonéale, le traitement est le plus souvent chimiothérapique avec ou sans chimiothérapie hyperthermique intra péritonéale. De nouvelles stratégies thérapeutiques utilisant l’immunothérapie sont maintenant disponibles en cancérologie et doivent être intégrées dans la stratégie thérapeutique. C’est le cas du catumaxomab qui est un anticorps monoclonal hybride de rat/souris dirigé spécifiquement contre la molécule d’adhésion cellulaire épithéliale (EpCAM) et l’antigène CD3. L’antigène EpCAM est surexprimé dans la plupart des carcinomes. Le CD3 est exprimé sur les lymphocytes T matures au sein du récepteur du lymphocyte T. Le Catumaxomab induit une réaction immunologique concertée contre les cellules tumorales, faisant intervenir différents mécanismes d’action tels que l’activation des lymphocytes T, la cytotoxicité à médiation cellulaire dépendant des anticorps ou du complément et la phagocytose. Ceci aboutit à la destruction des cellules tumorales [16]. L’utilisation du catumaxomab est indiquée pour le traitement intrapéritonéal de l’ascite maligne chez les patients atteints de carcinomes EpCAM-positifs lorsque le traitement standard n’est pas disponible ou lorsque celui-ci n’est plus utilisable. Les résultats des essais de phase II/III, en particulier dans les carcinoses péritonéales au cours des cancers de l’estomac ou ovariens, ont démontré une efficacité statistiquement significative sur la durée de survie sans ponction, qui était quatre fois supérieure à celle du groupe témoin [16, 17]. L’administration du catumaxomab est réalisée en quatre perfusions intrapéritonéales. La balance bénéfice/risque de ce traitement reste discutée. La combinaison d’une immunothérapie par catumaxomab avec la chirurgie ou la chimiothérapie systémique nécessite d’être évaluée [18].
En cas d’ascite tuberculeuse, un traitement de 6 mois est nécessaire en débutant par une quadrithérapie de 2 mois. Il faudra vérifier la sensibilité phénotypique de la souche en culture à l’isoniazide. Pour éviter, une fibrose péritonéale secondaire, une corticothérapie de quelques semaines est introduite dans les tuberculoses pulmonaires florides [9].
Au cours du syndrome de Budd-chiari, le traitement anticoagulant ou du facteur de thrombophilie associé est nécessaire et peut être complété par la mise en place d’un shunt porto sus hépatique par voie Trans jugulaire [19]. Le traitement du foie cardiaque sera le plus souvent médical sauf en cas de péricardite constrictive où il sera chirurgical.
Les ascites chyleuses nécessitent la mise en place de mesures nutritionnelles avec l’utilisation de triglycérides à chaîne moyenne et hyper protidique alors qu’une reprise chirurgicale est proposée en cas d’ascite chyleuse post-opératoire. Un traitement par Somatostatine a montré une certaine efficacité pour des ascites chyleuses post-opératoires [12].
Dans le cas de l’hypertension portale non cirrhotique, la prise en charge est plus difficile avec le traitement de la cause lorsqu’elle a été identifiée. En particulier l’arrêt du médicament s’il s’agit d’une toxicité médicamenteuse ou le traitement de la connectivite par exemple sont indispensables. La mise en place d’un shunt porto sus hépatique par voie transjugulaire en cas d’ascite réfractaire aux diurétiques a une efficacité inconstante avec peu de cas publiés [13].
Conclusion
Le diagnostic de la cause d’une ascite non cirrhotique nécessite une approche globale du patient en raison de la mul-
tiplicité des pathologies potentiellement responsables. L’analyse du contexte de survenue et du liquide de ponction permet dans la majorité des cas d’orienter le diagnostic. L’ascite dans ce cadre là n’est qu’un symptôme et le traitement de la maladie causale est indispensable.
Références
- McHutchison JG. Differential diagnosis of ascites. Semin Liver Dis 1997;17:191-202.
- Tarn AC, Lapworth R. Biochemical analysis of ascitic (peritoneal) fluid: what should we measure? Ann Clin Biochem 2010;47:
397-407. - Runyon BA, Montano AA, Akriviadis EA, Antillon MR, Irving MA, McHutchison JG. The serum-ascites albumin gradient is superior to the exudate- transudate concept in the differential diagnosis of ascites. Ann Intern Med 1992;117:215-20.
- Sevinc A, Sari R, Fadillioglu E. The utility of lactate dehydrogenase isoenzyme pattern in the diagnostic evaluation of malignant and nonmalignant ascites. J Nalt Med Assoc 2005;97:79-84.
- Liao YJ, Wu CY, Lee SW, Lee CL, Yang SS, Chang CS, et al. Adenosine deaminase activity in tuberculous peritonitis among patients with underlying liver cirrhosis. World J Gastroenterol 2012;18:5260-5.
- Manohar A, Simjee AE, Haffejee A, et al. Symptoms and investigative findings in 145 patients with tuberculous peritonitis diagnosed by peritoneoscopy and biopsy over a five years period. Gut 1990;31:1130-2.
- Sangisetty S, Miner T. Malignant ascites: a review of prognosis factors, pathophysiology and therapeutic measures. World J Gastrointest Surg 2012;4:87-95.
- Kim NJ, Choo EJ, Kwak YG, Lee SO, Choi SH, Woo JH, et al. Tuberculous peritonitis in cirrhotic patients: comparison of spontaneous bacterial peritonitis caused by Escherichia coli with tuberculous peritonitis. Scand J Infect Dis 2009;41:852-6.
- Chow KM, Chow VC, Hung LC, Wong SM, Szeto CC. Tuberculous peritonitis- associated mortality is high among patients waiting for the results of mycobacterial cultures of ascitic fluid samples. Clin Infect Dis 2002;35: 409-13.
- Ayantunde A, Parsons S. Pattern and prognosis factors in patients with malignant ascites: a restrospective study. Ann Oncol 2007;18:
945-9. - Chirieac LR, Pinkus GS, Pinkus JL, et al. The immunohistochemical characterization of sarcomatoid malignant mesothelioma of the pleura. Cancer Res 2011;1:14-24.
- Ha G, Lee M. Surgical repair of intractable chylous ascites following laparoscopic anterior resection. World J Gastroenterol 2015;21:
6077-81. - Khanna R, Sarin S. Non cirrhotic portal hypertension – diagnosis management. J Hepatol 2014;60:421-41.
- Schouten JN, Garcia Pagan JC, Valla DC, Jansen H. Idiopathic non cirrhotic portal hypertension. Hepatology 2011;54:1071-81.
- Cazals Hatem D, Rautou E, Valla D-C. The significance of non obstructive sinusoidal dilatation of the liver: impaired portal perfusion or inflammatory reaction syndrome. Hepatology 2015;62:956-63.
- Jager M, Schoberth A, Ruf P, et al. Immunomonitoring results of a phase II/III study of malignant ascites patients treated with the trifunctional antibody catumaxomab (anti-EpCAMxanti-CD3). Cancer Res 2012;72:
24-32. - Sehouli J, Pietzner P, Vergote I, et al. Catumaxomab with and without prednisolone premedication for the treatment of malignant ascites due to peritoneal cancer: results of the randomized phase IIIb CASIMAS study. Med Oncol 2014;8:76.
- Goéré D, Gras-Chaput N, Aupérin A, et al. Treatment of gastric peritoneal carcinomatosis by combining complete surgical resection of lesions and intraperitoneal immunotherapy using catumaxomab. BMC cancer 2104;14:141-8.
- Tripathi D, Macnicholas R, Sunderraj L, et al. Good clinical outcomes following transjugular intrahepatic stent-shunts in Budd-Chiari syndrome. Aliment Pharmacol Ther 2014;39:864-72.
Les cinq points forts
- Rechercher une maladie générale associée en particulier une tuberculose ou une néoplasie.
- Faire une ponction et demander une analyse complète du liquide d’ascite (cytologie et biochimie puis bactériologie voire parasitologie).
- Évaluer le gradient d’albumine sérum-ascite qui oriente vers l’étiologie.
- Documenter une éventuelle atteinte péritonéale par un examen tomodensitométrique.
- Rechercher une hypertension portale non cirrhotique sur les critères de Schouten.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
