Manifestations dermatologiques au cours des maladies inflammatoires chroniques de l’intestin
Objectifs pédagogiques
- Connaître les lésions cutanées associéesaux MICI
- Connaître les pathologies dermatologiques induites par les immunosuppresseurs et les anti TNF et leur prise en charge
- Connaître le risque de cancers cutanés dans les MICI et leurs préventions
Introduction
Les manifestations dermatologiques (cutanées et/ou muqueuses) apparaissant au cours des maladies inflammatoires chroniques de l’intestin (MICI) peuvent être variées et comprendre : 1/Les atteintes dermatologiques directement ou indirectement associées aux MICI comme les dermatoses spécifiques (granulomateuses), réactionnelles, et les manifestations cutanées d’origine carentielle, 2/ les atteintes dermatologiques associées à l’utilisation des traitements immuno-modulateurs tels les anti-TNFα (Tableau I). Ces dermatoses sont un motif fréquent de consultation pour les dermatologues et renforcent la prise en charge transversale des patients atteints de MICI. Dans cette revue nous évoquerons successivement l’ensemble de ces dermatoses associées au MICI et aborderons le risque de cancers cutanés chez les patients atteints de MICI.

Tableau I. Les manifestations cutanées des Maladies Inflammatoires Chroniques de l’Intestin
Les dermatoses associées aux MICI
Ainsi plusieurs types de manifestations cutanées ont été décrits dans le contexte des MICI. Ces dermatoses ne sont pas forcément dépendantes de l’évolution des MICI et peuvent même apparaître avant le développement des symptômes digestifs permettant ainsi de faire le diagnostic de MICI de façon plus précoce [1]. La prévalence des manifestations cutanées au cours des MICI est relativement similaire pour la MC et la RCH (9 %-19 % pour la MC, 9 %-23 % pour la RCH). Certaines manifestations cutanées peuvent se rencontrer à la fois dans la MC ou la RCH, cependant certaines sont spécifiques de l’une ou l’autre, en raison des différences dans les mécanismes physiopathologiques de ces deux maladies. Par exemple, certaines manifestations cutanéo-muqueuses granulomateuses sont spécifiques de la MC, d’autres pouvant être observées dans les deux pathologies. Parmi les affections dites réactionnelles, sont retrouvées l’érythème noueux, une aphtose mais surtout le grand groupe des dermatoses neutrophiliques. Certaines dermatoses peuvent être d’origine carentielle liées aux conséquences de l’anorexie, la malabsorption ou les augmentations des besoins protéino-énergétiques associés aux symptômes des MICI. Enfin certaines dermatoses inflammatoires bien identifiées peuvent se retrouver associées aux MICI.
Les lésions granulomateuses spécifiques
Ces lésions sont liées à l’atteinte directe de la peau par un processus inflammatoire identique à celui présent dans le tractus gastro-intestinal. Sans surprise, ces lésions sont retrouvées au cours de la MC dont elles sont parfois très évocatrices. Elles sont définies par un granulome giganto-cellulaire sans nécrose-caséeuse, parfois visible sur la biopsie que dans 1/3 des cas. Lorsque l’atteinte concerne la région ano-périnéale ou la sphère oro-faciale, il s’agit de lésions par contiguïté. Lorsqu’elles surviennent à distance du tube digestif, les lésions sont dites « métastatiques ».
Les lésions ano-périnéales
Ce sont les atteintes les plus fréquentes des atteintes cutanées et/ou muqueuses de la MC. Elles sont observées dans près de 36 % des cas dans une étude de 569 patients atteinte de MC et de façon plus fréquente en cas d’atteinte colique. Ces lésions peuvent précéder les signes digestifs dans 8 à 30 % des cas, parfois de quelques mois, voire de plusieurs années mettant le dermatologue parfois en première ligne pour le diagnostic de la MC. Les aspects cliniques sont très variés : fissures péri-anales plus larges que les fissures banales, lésions végétantes pseudotumorales, ulcérations linéaires et profondes avec des bords nets dites « en coup de couteau », ulcérations creusantes pouvant entraîner une destruction du sphincter anal, abcès se compliquant de fistules anales, périnéales ou recto-vaginales. L’évolution de ces lésions est marquée par des successions de poussées et de rémissions, généralement indépendantes de l’activité intestinale de la MC. Du fait de la chronicité de ces lésions, il est important de dépister la survenue de carcinomes épidermoïdes par un examen clinique régulier et la réalisation de biopsies au moindre doute.
Les lésions génitales
Elles s’observent en général chez des patients dont la MC, le plus souvent colique ou colorectale, est connue depuis plusieurs années. Elles peuvent dans certains cas précéder les manifestations intestinales. Ces atteintes génitales sont parfois isolées, mais sont plus souvent associées aux atteintes ano-périnéales. Chez la femme, le diagnostic doit être évoqué en présence d’ulcérations linéaires vulvaires profondes dites « en coup de couteau » ou d’un œdème labial induré douloureux, souvent asymétrique (Fig. 1). Les localisations masculines sont exceptionnelles et se présentent sous la forme d’œdème scrotal et/ou pénien, de phimosis serré acquis, d’ulcérations chancriformes ou linéaires caractéristiques.

Figure 1. Ulcérations génitales et cutanées spécifiques en « coup de couteau »
Les lésions oro-faciales

Figure 2. Chéilite et oedème labial avec dermite péri-orale dans le cadre d’une maladie de Crohn
Ces lésions comme les lésions pano-périnéales sont considérées comme une extension de l’atteinte inflammatoire digestive et peuvent se rencontrer dans 8-9 % des MC. De nombreuses lésions peuvent être observées : ulcérations linéaires à bords hyperplasiques des sillons gingivojugaux, ulcérations de présentation trompeuse car prenant l’aspect d’aphtes, lésions polypoïdes de la muqueuse vestibulaire ou jugale, hypertrophie gingivale, hyperplasie œdémateuse et fissurée de la face interne des joues réalisant un aspect « en pavé » (cobblestone), proche de celui observé sur la muqueuse intestinale, chéilite granulomateuse qui se manifeste par un œdème induré d’une ou des deux lèvres, épisodique au début puis permanent (Fig. 2). L’atteinte labiale est habituellement asymétrique, fissuraire et s’accompagne d’une perlèche. Les biopsies profondes sont nécessaires pour mettre en évidence les petits granulomes non caséeux qui permettent de retenir le diagnostic de granulomatose oro-faciale, mais pas de MC quand la macrochéilite est isolée. En l’absence d’argument pour une sarcoïdose, il faut réaliser un bilan digestif au moindre signe d’appel, car ce tableau de GOF est souvent précoce et peut précéder de plusieurs années les manifestations intestinales surtout chez l’enfant. L’observation de lésions de la muqueuse buccale impose l’examen de la muqueuse anale, car ces deux sites sont souvent atteints de manière concomitante [2].
Les lésions cutanées
Elles sont rares et extrêmement trompeuses car d’un grand polymorphisme clinique. Ces lésions sont retrouvées préférentiellement au niveau des extrémités ou au niveau des plis. Des atteintes rares et inhabituelles à type d’érythème facial, de nodules acnéiformes, de pseudoérysipèle ont été rapportées. Des lésions nodulaires ou des plaques érythémateuses indurées parfois ulcérées ou végétantes sont peut-être plus évocatrices chez ces patients dont la MC est en règle connue depuis de nombreuses années, mais habituellement quiescente. Les localisations métastatiques inaugurales sont exceptionnelles. Il ne faut donc pas hésiter à biopsier systématiquement toute manifestation dermatologique inhabituelle au cours d’une MC. Histologiquement, la sarcoïdose représente le principal diagnostic différentiel. Le traitement des lésions spécifiques de MC est souvent difficile et n’est pas codifié. Bien que le traitement de la MC soit le traitement de choix, la résection chirurgicale du segment digestif atteint ne garantit pas l’amélioration thérapeutique de ces lésions cutanées. Le rôle aggravant du tabac, bien identifié pour l’atteinte digestive, n’a pas été évalué pour ce qui est des lésions cutanées. Il est cependant indispensable d’obtenir le sevrage tabagique s’agissant de lésions particulièrement résistantes aux traitements médicaux.
Les dermatoses réactionnelles
Elles n’évoluent pas toujours parallèlement aux poussées digestives et ne sont pas toujours sensibles aux traitements de la MC. Les plus fréquentes d’entre elles sont l’érythème noueux, l’aphtose buccale, et le Pyoderma gangrenosum.
L’érythème noueux (EN)
L’erythème noueux (EN) est probablement l’atteinte cutanée la plus fréquente au cours des MICI, touchant 4 % à 6 % des patients. Sa prévalence semble plus importante au cours de la MC qu’au cours de la RCH. L’EN touche plus préférentiellement la femme jeune (entre 10 et 30 ans). Parfois récidivant avec un intervalle entre les poussées variant de quelques semaines à quelques années, l’EN survient souvent pendant la première année d’évolution d’une MICI. Il est le plus souvent typique et s’accompagne d’arthrites. Il peut aussi présenter quelques particularités : peu d’éléments, atteinte unilatérale, localisation à la face postérieure des jambes et aux membres supérieurs. Il s’agit parfois d’une poussée inaugurale et l’existence de manifestations digestives au cours d’un EN doit amener à chercher systématiquement une MC dès lors qu’une infection intestinale (yersiniose, salmonellose, shigellose, infection à Campylobacter, etc.) aura été éliminée. Dans une étude de 792 patients atteints de MICI, tous les patients (n = 48) avec un EN synchrone ont eu une rémission de cette atteinte cutanée par le traitement de la maladie digestive sous-jacente [3].
L’aphtose buccale
Sa prévalence est d’environ 20 % au cours de la MC. Cependant comme il s’agit d’un symptôme relativement fréquent dans la population générale, sa relation avec l’évolution de la MICI semble difficile à évaluer. Il s’agit le plus souvent d’aphtes communs. On peut aussi observer une aphtose miliaire, des aphtes à tendance extensive, ou des aphtes bipolaires. Les aphtes peuvent précéder les manifestations digestives, aussi doit-on vérifier devant toute aphtose récidivante l’absence de tendance diarrhéique, de lésion périanale, de déficit en acide folique, fer ou vitamine B12 en rapport avec une malabsorption et pratiquer au moindre doute une exploration digestive, surtout s’il existe une notion d’antécédent familial de MICI.
Les dermatoses neutrophiliques (DN)
Il s’agit d’un groupe d’affections non infectieuses ayant en commun une image histologique (infiltrat neutrophilique aseptique dermique, mais pouvant également être épidermique ou hypodermique), une sensibilité aux thérapeutiques anti-inflammatoires agissant sur les neutrophiles (corticoïdes, dapsone, colchicine) et l’association fréquente à des maladies systémiques. Il existe un spectre continu entre les différentes entités composant les dermatoses neutrophiliques, conduisant à définir le concept de « maladie neutrophilique » qui sous-entend l’association de manifestations non spécifiques (signes généraux, arthralgies…) et de localisations extracutanées spécifiques (pulmonaires, hépatiques, etc.) dont la fréquence est probablement sous-estimée, surtout au cours du Pyoderma gangrenosum (PG) et du syndrome de Sweet (SS) [4].
Le Pyoderma gangrenosum (PG)
Il complique 1 à 3 % des MICI, plus fréquemment une MC dont l’atteinte est plutôt pancolique, mais n’est pas corrélé à la sévérité de l’affection digestive. À l’inverse, les MICI représentent la première étiologie de PG (20 à 30 % des cas). Certaines études semblent montrer que le PG est plus fréquent en cas de RCH que de MC. Les lésions sont uniques ou multiples, récidivent dans un tiers des cas et sont parfois accompagnées d’ulcérations aphtoïdes endobuccales assimilées à un PG muqueux. Le PG débute par l ‘apparition de pustules stériles qui progressent rapidement vers des ulcères très douloureux de profondeur et de tailles variables aux bords bleutés ou violacés mal limités entourés d’un érythème (Fig. 3). Le PG apparaît habituellement après une dizaine d’années d’évolution de la MICI le plus souvent, mais non constamment au cours d’une de ses poussées. Une atteinte ophtalmologique (uvéite) est fréquemment associée.
Il peut cependant précéder la symptomatologie intestinale, ce qui justifie en l’absence d’étiologie hématologique ou rhumatologique l’exploration endoscopique systématique s’il s’agit d’une forme récidivante, s’il existe des signes d’appels digestifs, et a fortiori en cas d’antécédent familial de MICI. La localisation péristomiale est rare. Il s’agit essentiellement de malades atteints de MC avec iléostomie. Ce type de PG, favorisé par les diverses agressions auxquelles est soumise la peau péristomiale, apparaît en moyenne deux mois après la réalisation de la stomie, mais des périodes plus longues, allant jusqu’à trois ans, ont été observées. Les produits iodés doivent être évités du fait d’un phénomène de pathergie à l’iode (activation des polynucléaires neutrophiles). Le PG ne suit pas toujours l’évolution de la MICI, ne répond pas toujours au traitement de la MICI. Le PG localisé associé aux MICI peut être traité par soins locaux : dermocorticoïdes, tacrolimus pommade ou injection intralésionnelle de corticoïdes. Dans le cas de PG multiples et évolutifs associés à une MICI active, les traitements systémiques sont recommandés : les corticoïdes sont souvent nécessaires. Les immunosuppresseurs, et surtout les anti-TNF, représentent les alternatives thérapeutiques possibles. Les anti-TNF sont actuellement indiqués en seconde intention après échec des corticoïdes et/ou des immunosuppresseurs.
Le syndrome de Sweet (SS)
Le syndrome de Sweet (SS) se caractérise par l’apparition rapide d’une fièvre, d’une neutrophilie sanguine et de lésions cutanées papuleuses ou nodulaires érythémateuses tendues avec parfois des lésions volontiers pustuleuses, voire bulleuses et plus rarement nécrotiques. Les lésions sont localisées de façon asymétrique au niveau des membres supérieurs, du visage et du cou (Fig. 3). L’incidence du SS au cours des MICI est cependant moins fréquente que le PG. Il semble que le SS soit plus fréquent chez les patients de sexe féminin atteints de MC que de RCH. Le SS est fréquemment associé avec une MICI active dans environ 67 %-80 % des cas. Le traitement est principalement basé sur l’utilisation des corticoïdes systémiques. La récurrence est fréquente (1/3 des cas), notamment à la décroissance de la corticothérapie générale. Un traitement par immunosuppresseurs comme la ciclosporine, la dapsone, l’azathioprine ou les anti-TNFα peuvent être discutés.

Figure 3. Dermatose neutrophilique : pyoderma gangrenosum (à gauche), syndrome de Sweet bulleux et pustuleux
(au centre et à droite)
Le syndrome arthrocutané
C’est au cours des années 70 que l’attention a été attirée sur les possibles complications cutanées et articulaires des dérivations jéjunoiléales en relation avec la pullulation bactérienne dans l’anse borgne et la formation de complexes immuns circulants. Ce « bowel-bypass syndrome » a été par la suite décrit chez des patients gastrectomisés, mais aussi en l’absence de toute chirurgie, en association avec la MC, bien que moins fréquemment qu’avec la rectocolite hémorragique (RCH). L’éruption est constituée de pustules non folliculaires, reposant sur une base érythémateuse.
D’une taille variant de 2 à 8 mm de diamètre, elles siègent principalement sur la face externe des membres supérieurs, la face d’extension des membres inférieurs, mais aussi le tronc, voire le cuir chevelu. L’éruption s’accompagne toujours de manifestations systémiques plus ou moins marquées : fièvre, myalgies, polyarthralgies, arthrites périphériques, conjonctivite. L’examen histologique associe des signes de pustulose sous-cornée et de SS sans nécrose fibrinoïde vasculaire. Le diagnostic différentiel se pose avec les manifestations cutanées des septicémies, la maladie de Behçet du fait de l’aspect de pseudo-folliculite, le SS et le PG vis-à-vis desquels le problème est surtout nosologique. En effet, chez certains malades coexistent des lésions pustuleuses et des éléments de plus grande taille, évocateurs de l’une ou l’autre de ces deux dermatoses, ce qui conforte la notion de maladie neutrophilique avec formes de passage et chevauchements.
La pyostomatitepyodermite végétante (PPV)

Figure 4. Pyostomatite végétante
La PPV est une affection rare dont la particularité est d’être associée dans 75 % des cas à une MICI qu’elle peut révéler : c’est alors plus souvent une RCH qu’une MC. Il s’agit d’une entité rare : 40 cas ont été publiés dans la littérature et tous ces cas étaient associés à une MICI. Cliniquement, il s’agit de pustules de la muqueuse buccale qui, par coalescence, donnent un aspect très caractéristique en « traces d’escargots ». Elles siègent principalement sur les gencives, la face interne des joues, le palais et les lèvres (Fig. 4).
La langue et le plancher buccal sont respectés. Ces lésions indolores se rompent facilement et font place à des érosions à tendance végétante. Dans la moitié des cas, il existe des lésions pustuleuses et végétantes cutanées, localisées préférentiellement au scalp et aux grands plis, justifiant l’appellation « pyostomatite-pyodermite végétante ». Ces lésions apparaissent généralement en même temps que les lésions muqueuses, voire secondairement, ce qui en facilite le diagnostic.
Les abcès aseptiques
De façon exceptionnelle, des abcès sous-cutanés aseptiques correspondant vraisemblablement à des formes profondes de SS, ont été rapportés au cours de MICI. Par ailleurs, des abcès viscéraux peuvent révéler, voire précéder de plusieurs mois une MICI. Il s’agit préférentiellement d’abcès spléniques, hépatiques ou ganglionnaires.
Les manifestations carentielles
Les carences sont globales ou sélectives (vitamines, folates, fer, protides, surtout acides gras essentiels et zinc…). Les manifestations cutanéo-muqueuses y sont fréquentes et variées, évocatrices dans certains cas, mais trompeuses ou non spécifiques dans d’autres. Certaines comme la glossite et la chéilite sont communes à plusieurs déficits, mais il existe assez souvent des manifestations dominantes qui permettent d’orienter le diagnostic et d’envisager un traitement d’épreuve, véritable test thérapeutique plus informatif que les dosages sériques et urinaires :
- une éruption photodistribuée doit faire évoquer le diagnostic de pellagre (carence en vitamine PP = vitamine B3 = niacine), ce d’autant que les analogues puriques (azathioprine, 6-mercaptopurine, 6-thioguanine) peuvent générer cette carence ;
- devant une hyperkératose folliculaire (Fig. 5), il faut chercher une carence en vitamine A (rétinol) ou C. L’hyperkératose folliculaire du tronc et des membres, associée à un purpura pétéchial périfolliculaire et des poils en tirebouchon est très évocatrice de la carence en vitamine C. La gingivite hypertrophique hémorragique est plus tardive ;
- des ecchymoses des zones de pression doivent faire penser aux carences en vitamine C ou K (Fig. 5) ;
- il faut demander une NFS en présence d’une glossite. En cas d’anémie macrocytaire, on pense aux carences en vitamine B12 ou B9, tandis que l’anémie microcytaire évoque la carence martiale ;
- une dermite d’aspect séborrhéique, et/ou dermite eczématiforme avec atteinte périorificielle, fait évoquer un déficit en vitamines du groupe B, ou une carence en zinc et/ou en acides gras essentiels. La carence en zinc est fréquente au cours des MC évoluant depuis plusieurs années, même en période de rémission. Une zincémie abaissée est notée dans 35 à 45 % des cas, mais n’est symptomatique que dans 10 % des cas environ. Le diagnostic doit être évoqué devant un intertrigo de la région génitale, une vulvite œdémateuse et suintante, un érythème douloureux scrotal, ou un eczéma craquelé. Il ne faut pas hésiter à prescrire un traitement d’épreuve, efficace en quelques jours, en doublant la dose usuelle du fait de la malabsorption (gluconate de zinc 2 gélules × 2/jour à prendre impérativement à jeun).
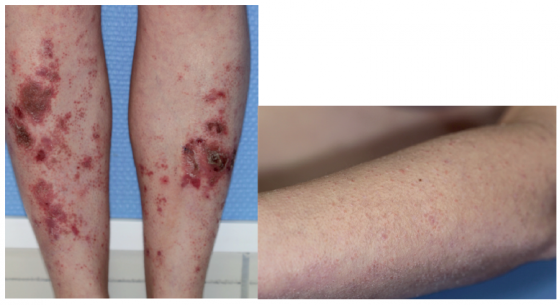
Figure 5. Dermatose carentielle au cours d’une maladie de Crohn :
Ecchymoses sur les zones de frottement et hyperkératose péri-folliculaire.
Les dermites péristomiales
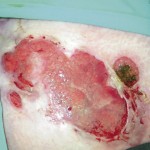
Figure 6. Dermite péri-stomiale à type
de pyoderma gangrenosum.
Ces dermatoses sont particulières car survenant dans le contexte de stomies surtout en cas d’iléostomies. Les étiologies sont diverses et reprennent certaines des causes décrites dans les paragraphes précédents. En dehors des dermatoses préexistantes (eczéma, psoriasis) et souvent auto-entretenues par la stomie, on distingue les lésions survenant précocement des dermatoses plus tardives et souvent chroniques. Dans le premier groupe, on trouve le PG postopératoire, la fistule entéro-cutanée ou l’hématome surinfecté (Fig. 7). Plus tardivement, on observe des lésions spécifiques comme des atteintes métastatiques de la MC et surtout des dermites irritatives ou caustiques qui se compliquent fréquemment de surinfections bactériennes ou fongiques. Les vraies dermatites de contact (latex, pâtes adhésives…) sont rares, nécessitant des explorations de contact au moindre doute. Pour terminer, les diagnostics sus-cités ayant été éliminés, il faut savoir évoquer une pathomimie. L’intervention d’une infirmière stomathérapeute est souvent requise pour venir à bout de ces dermatoses péristomiales dont la désespérante chronicité altère très sérieusement la qualité de vie des malades.

Figure 7. Eruptions psoriasiformes sous anti-TNFa
Les autres manifestations associées aux MICI.
Ces entités sont des maladies inflammatoires ou auto-immunes présentant des facteurs de prédisposition génétique parfois communs avec les MICI. Ces entités ont une évolution indépendante de celle de la MICI [1].
Épidermolyse bulleuse acquise (EBA)
L’Epidermolyse Bulleuse Acquise (EBA) est une maladie autoimmune chronique caractérisée par la présence de bulles sous-épidermiques évoluant vers des cicatrices localisées préférentiellement sur les mains et pieds. Il s’agit d’une entité rare mais associée dans 30 % à une MICI, principalement la MC, ce qui justifie la réalisation d’un bilan digestif chez tout malade atteint d’EBA. La maladie bulleuse précède la découverte de la MICI, plus souvent la MC, dans à peu près la moitié des cas, et leurs évolutions sont indépendantes l’une de l’autre.
Autres maladies auto-immunes
Ont été rapportées de manière très ponctuelle : vitiligo, pelade, lupus érythémateux, sclérodermie, lichen, polychondrite, syndrome de Gougerot-Sjögren, vascularites et pan-artérite noueuse.
L’association au psoriasis est connue depuis le début des années 80. Dans une étude canadienne de 2005, les malades présentant une MC avaient un risque multiplié par 1,6 de développer un psoriasis par rapport à la population contrôle. À l’inverse, les sujets ayant un psoriasis avaient un risque à peu près similaire (x 1,52) de développer une MC. Même si ces ratios de prévalence doivent être affinés par des études prospectives, il est indéniable que de nombreuses connexions existent entre ces deux maladies [5].
Les lésions à type de suppuration périnéo-fessière chez des patients atteints de MICI ne doivent pas faire oublier le risque d’authentiques maladies de Verneuil ou hidrosadénite suppurée associée à la MICI. La maladie de Verneuil est une dermatose inflammatoire chronique, récidivante se caractérisant par la présence de nodules cutanés inflammatoires, d’abcès localisés préférentiellement au niveau des plis. Une étude portant sur une population de 679 suivis pour MICI rapporte un risque multiplié par 9 de développer une maladie de Verneuil chez ces patients comparativement à la population générale. Il semble que la maladie de Verneuil est plus sévère chez ces patients atteints de MICI. Des études prospectives sont en cours pour mieux préciser cette association [6].
Les lésions cutanées spécifiques, réactionnelles ou d’origine carentielle associées aux MICI ne doivent pas faire oublier le risque des effets secondaires cutanées associés aux traitements utilisés dans ces pathologies chroniques, notamment les biothérapies par anti- TNFα.
Eruptions psoriasiformes induites par les anti-TNFα
L’utilisation des anti-Tumor Necrosis Factor (TNF)a a considérablement modifié la prise en charge des MICI. Cependant, des effets secondaires en particulier cutanés, ont été rapidement décrits chez les patients traités par ces molécules, notamment les éruptions psoriasiformes sous anti-TNFα.
Ces éruptions, décrites pour la première fois en 2003, ont été principalement rapportées chez les patients suivis pour rhumatisme inflammatoire, maladies inflammatoires chroniques de l’intestin ou psoriasis. Ces éruptions ont été observées avec tous les anti-TNFa, actuellement disponibles avec une fréquence plus importante pour les anticorps monoclonaux comme l’infliximab ou l’adalimumab. La prévalence semble être de l’ordre de 5 % des patients traités comme cela a été évoqué dans une cohorte de patients atteints de MICI [7]. Ces éruptions surviennent dans un intervalle très variable d’un patient à l’autre allant de quelques semaines à plusieurs années (≈ 5 ans). Dans la majorité des cas, la réponse des patients à l’anti-TNFa prescrit pour la maladie sous-jacente est excellente, posant parfois des problèmes importants pour la prise en charge thérapeutique de ces patients, et mettant parfois en question le maintien de la biothérapie.
La présentation clinique est également variable. L’atteinte la plus fréquemment rapportée est la pustulose palmo-plantaire (≈ 50 % des cas), correspondant à une atteinte érythémateuse et/ou pustuleuse touchant les paumes et plantes (Fig. 7). D’autres atteintes ont été décrites comme une atteinte psoriasiforme inversée prédominant au niveau des régions pelviennes, inguinales et rétro-auriculaires parfois suintante, croûteuse et très invalidante. L’atteinte du cuir chevelu peut évoluer d’un simple état squameux vers une atteinte inflammatoire alopéciante, croûteuse et érosive. Il est important de noter que lorsque ces éruptions apparaissent chez un patient traité par anti-TNFa pour un psoriasis, les éruptions psoriasiformes apparaissent souvent sur des localisations différentes du psoriasis initial. Par ailleurs, l’apparition d’une éruption psoriasiforme chez un patient traité par anti-TNFa pour une spondylarthropathie initialement non classée peut parfois faire porter le diagnostic à tort de rhumatisme psoriasique [8].
Les mécanismes physiopathologiques de ces éruptions psoriasiformes ne sont pas encore complètement compris. Les premières descriptions rhumatologiques évoquaient un « psoriasis vrai » induit par ces biothérapies. Par la suite, l’analyse histologique de nos patients a permis de mieux préciser ces éruptions : l’aspect histologique retrouvait certaines caractéristiques du psoriasis comme une hyperplasie épidermique mais différaient cependant par d’autres éléments comme la présence de nécroses kératinocytaires, d’un infiltrat lichénoïde (disposition en bande au niveau de la jonction dermo-épidermique de l’infiltrat inflammatoire) et parfois d’un infiltrat éosinophilique. Ces données ont par la suite été confirmées par d’autres équipes. Ainsi ces éruptions apparaissent actuellement plus comme un modèle de toxidermie induite par la classe thérapeutique des anti-TNFa que comme des psoriasis véritables induits, justifiant le terme d’éruptions psoriasiformes. Par la suite, nous avons pu montrer que le blocage du TNFa s’accompagnait d’un déséquilibre cytokinique à l’origine d’une production exagérée d’une autre cytokine inflammatoire, l’interféron (IFN)-a, exprimé de façon importante au sein des lésions [9, 10]. De plus, d’autres équipes ont pu démontrer également l’expression exagérée au sein des lésions d’autres cytokines comme l’IL-17 et l’IL-22 justifiant chez ces patients l’utilisation de l’ustekinumab [11].
Sur le plan thérapeutique, compte tenu de la bonne réponse de l’organe cible du patient aux anti-TNFa prescrits, la décision d’un arrêt de la biothérapie reste difficile et il est important d’estimer risques et bénéfices pour le patient. Dans la majorité des cas, le traitement par anti-TNFa peut et doit être maintenu. Le Tableau 2 propose un algorithme décisionnel adapté de l’étude Collamer AN et al. [12]. Dans notre expérience, un traitement local et/ou systémique associé à la poursuite des anti-TNFa permet de contrôler la symptomatologie cutanée tout en maintenant une bonne réponse sur la pathologie initiale nécessitant le traitement par anti-TNFa, dans la plus grande majorité des cas. Parfois, compte tenu de la sévérité des lésions et du retentissement clinique, le traitement par anti-TNFa doit être adapté, voire suspendu. Il a été parfois montré que le remplacement par un autre anti-TNFa pouvait être proposé sans récidive des lésions. Cependant, comme ces éruptions sont liées à un effet classe, cette attitude reste discutée. Désormais le développement de nouvelles biothérapies ciblant d’autres voies inflammatoires autres que le TNFa en gastro-entérologie permet une meilleure adaptation thérapeutique. Il a d’ailleurs été montré, dans certains cas sévères d’éruptions psoriasiformes sous anti-TNFα, l’intérêt de l’ustekinumab (Stelara®) pour améliorer cet effet secondaire et maintenir le contrôle de la maladie digestive sous-jacente. Cependant il est important de noter que, dans certains cas, ces éruptions peuvent s’autonomiser même après arrêt de la biothérapie en cause.

Tableau 2. Organigramme décisionnel en cas d’éruption psoriasiforme sous anti-TNFa
Ainsi, les éruptions psoriasiformes sous anti-TNFα peuvent être désormais reliées à une nouvelle forme de toxidermie induite, non pas par un mécanisme allergique mais par une modification du profil inflammatoire cytokinique associé au blocage spécifique d’une cytokine par la biothérapie utilisée. Ainsi il est envisageable de voir l’émergence de ce type de réactions cutanées avec le développement ou l’utilisation actuelle d’autres biothérapies ou de petites molécules bloquant d’autres cibles inflammatoires.
Cancers cutanés et MICI
Le recul de plus en plus important concernant le suivi des patients atteints de MICI et traités par immunosuppresseurs ou immunomodulateurs permet de mieux préciser les risques de cancers cutanés dans ces populations. En effet des études récentes suggèrent un risque plus important de mélanome ou de cancers cutanés non mélaniques (carcinome épidermoïde ou carcinome baso-cellulaire). L’étude de la cohorte CESAME a ainsi identifié un risque de cancers cutanés non mélaniques chez les patients prenant ou antérieurement exposés aux thiopruines (azathioprine)[13]. Une étude américaine rétrospective par Long DM et al. [14], basée sur des registres administratifs des assurances maladies a montré que les patients atteints de MICI présentaient un risque augmenté de mélanome, plus important chez les patients atteints de MC. Par ailleurs concernant les traitements utilisés, il semble que le traitement par anti-TNFα augmente ce risque de mélanome. Cependant aucune association n’a été retrouvée entre mélanome et traitement par thiopurines. Une récente méta-analyse basée sur des études de registres et de cohortes menées pour la plupart avant l’ère des traitements par biothérapies a montré un risque de mélanome chez les patients suivis pour MICI et ceci de façon indépendante de l’utilisation des traitements par biothérapies [15]. Concernant les cancers cutanés non mélaniques, l’étude de Long DM et col a montré un risque augmenté de ces cancers chez les patients traités par anti-TNFα ou thiopurines. Dans une analyse de sous-groupe, il semble que l’utilisation des anti-TNFα ou des thiopurines pour une durée supérieure à 1 an montre le risque le plus important. Cependant une récente méta-analyse a évalué le risque de cancers cutanés non mélaniques chez les patients atteints de MICI et traités par thiopurines [16]. Cette méta-analyse, basée sur 8 études regroupant des études de registre administratif et des études de cohorte, semble cependant montrer, malgré une importante hétérogénéité, un risque très modéré de cancers cutanés non mélaniques chez ces patients.
Ces données soulignent l’importance de l’information des patients suivis pour MICI concernant le risque de mélanome et de cancers cutanés non mélaniques. La surveillance cutanée de ces patients semble également nécessaire, ainsi que les mesures de prévention sur l’exposition solaire et les mesures de photoprotection avec des écrans protégeant contre les UVA et UVB et des facteurs de protection SPF > 30.
Conclusion
Les manifestations cutanées associées aux MICI peuvent être extrêmement variées nécessitant une interaction étroite entre gastro-entérologues et dermatologues afin de mieux préciser les causes de ces lésions et mettre en place une stratégie thérapeutique adaptée au patient en fonction de l’activité et du traitement de fond de sa maladie sous-jacente. Par ailleurs, il est important que la surveillance cutanée à court, moyen et long termes des traitements utilisés soit réalisée afin de dépister des effets secondaires cutanées nécessitant parfois l’arrêt de ce traitement de fond.
Références
- Thrash B, Patel M, Shah KR, Boland CR, Menter A. Cutaneous manifestations of gastrointestinal disease: part II. Journal of the American Academy of Dermatology. 2013;68(2):211 e1-33; quiz 44-6.
- Campbell H, Escudier M, Patel P, Nunes C, Elliott TR, Barnard K, et al. Distinguishing orofacial granulomatosis from crohn’s disease: two separate disease entities? Inflamm Bowel Dis. 2011;17(10):2109-15.
- Veloso FT, Carvalho J, Magro F. Immune-related systemic manifestations of inflammatory bowel disease. A prospective study of 792 patients. J Clin Gastroenterol 1996;23(1):29-34.
- Marzano AV, Ishak RS, Saibeni S, Crosti C, Meroni PL, Cugno M. Autoinflammatory skin disorders in inflammatory bowel diseases, pyoderma gangrenosum and Sweet’s syndrome: a comprehensive review and disease classification criteria. Clinical reviews in allergy & immunology. 2013;45(2):202-10.
- Bernstein CN, Wajda A, Blanchard JF. The clustering of other chronic inflammatory diseases in inflammatory bowel disease: a population-based study. Gastroenterology. 2005;129(3):827-36.
- Yadav S, Singh S, Edakkanambeth Varayil J, Harmsen WS, Zinsmeister AR, Tremaine WJ, et al. Hidradenitis Suppurativa in Patients With Inflammatory Bowel Disease: A Population-Based Cohort Study in Olmsted County, Minnesota. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2015.
- Cleynen I, Vermeire S. Paradoxical inflammation induced by anti-TNF agents in patients with IBD. Nature reviews Gastroenterology & hepatology. 2012;9(9):496-503.
- Wollina U, Hansel G, Koch A, Schonlebe J, Kostler E, Haroske G. Tumor necrosis factor-alpha inhibitor-induced psoriasis or psoriasiform exanthemata: first 120 cases from the literature including a series of six new patients. American journal of clinical dermatology. 2008;9(1):1-14.
- Seneschal J, Milpied B, Vergier B, Lepreux S, Schaeverbeke T, Taieb A. Cytokine imbalance with increased production of interferon-alpha in psoriasiform eruptions associated with antitumour necrosis factor-alpha treatments. Br J Dermatol. 2009;161(5):1081-8.
- Seneschal J, Lepreux S, Bouyssou-Gauthier ML, Heliot-Hosten I, Economu A, Dehais J, et al. Psoriasiform drug eruptions under anti-TNF treatment of arthritis are not true psoriasis. Acta Derm Venereol. 2007;87(1):77-80.
- Tillack C, Ehmann LM, Friedrich M, Laubender RP, Papay P, Vogelsang H, et al. Anti-TNF antibody-induced psoriasiform skin lesions in patients with inflammatory bowel disease are characterised by interferon-gamma-expressing Th1 cells and IL-17A/IL-22-expressing Th17 cells and respond to anti-IL-12/IL-23 antibody treatment. Gut. 2014;63(4):567-77.
- Collamer AN, Guerrero KT, Henning JS, Battafarano DF. Psoriatic skin lesions induced by tumor necrosis factor antagonist therapy: a literature review and potential mechanisms of action. Arthritis Rheum. 2008;59(7):996-1001.
- Peyrin-Biroulet L, Khosrotehrani K, Carrat F, Bouvier AM, Chevaux JB, Simon T, et al. Increased risk for nonmelanoma skin cancers in patients who receive thiopurines for inflammatory bowel disease. Gastroenterology. 2011;141(5):1621-28 e1-5.
- Long MD, Martin CF, Pipkin CA, Herfarth HH, Sandler RS, Kappelman MD. Risk of melanoma and nonmelanoma skin cancer among patients with inflammatory bowel disease. Gastroenterology. 2012;143(2):390-9 e1.
- Singh S, Nagpal SJ, Murad MH, Yadav S, Kane SV, Pardi DS, et al. Inflammatory bowel disease is associated with an increased risk of melanoma: a systematic review and meta-analysis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2014;12(2):210-8.
- Ariyaratnam J, Subramanian V. Association between thiopurine use and nonmelanoma skin cancers in patients with inflammatory bowel disease: a meta-analysis. The American journal of gastroenterology. 2014;109(2):163-9.
Les quatre points forts
- La proportion des malades ayant des manifestations cutanées est de 9 % à 23 % dans la maladie de Crohn comme dans la rectocolite hémorragique
- Parmi ces manifestations cutanées, il faut distinguer les atteintes spécifiques, réactionnelles, carentielles et les dermatoses inflammatoires associées aux MICI.
- Les éruptions psoriasiformes sous anti-TNF sont un effet secondaire cutané de ces biothérapies. L’atteinte la plus fréquente étant la pustulose ou kératodermie palmoplantaire. Dans deux tiers des cas, la poursuite du traitement anti-TNF est possible.
- Le risque de cancers cutanés chez les patients traités par immunosuppresseurs et/ou biothérapies au long cours justifie une surveillance dermatologique régulière.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION