Nutrition préopératoire en chirurgie digestive réglée
Objectifs pédagogiques
- Reconnaître les patients à risque de complications postopératoires
- Évaluer ce risque en fonction de la lourdeur de l’intervention
- Savoir identifier une dénutrition
- Connaître les recommandations en matière de nutrition artificielle : voie orale, entérale ou parentérale, substrats, durée
Introduction
La situation périopératoire est celle pour laquelle les complications de la dénutrition sont les mieux connues et aussi celle pour laquelle le support nutritionnel atteint ses niveaux de preuve les plus élevés. Les précédentes recommandations francophones issues des travaux de la Société Française d’Anesthésie et Réanimation (SFAR) et de la Société Francophone Nutrition Clinique et Métabolisme (SFNEP) remontaient à 1994 ; elles viennent d’être réactualisées sous la forme de recommandations formalisées d’experts (RFE) [1] qui représentent le fil rouge de ce manuscrit.
Prévalence de la dénutrition
La période préopératoire est souvent précédée d’une période de jeûne (examens préopératoires) qui aggrave l’état nutritionnel, diminue le stock hépatique de glutathion et peut favoriser le développement d’une insulinorésistance. À cette période succède l’intervention chirurgicale qui constitue une véritable agression avec production d’hormones de stress et de médiateurs de l’inflammation. Sur le plan métabolique, il existe un accroissement de la dépense énergétique avec majoration de la protéolyse (bilan azoté négatif), hyperglycémie avec insulino-résistance et lipolyse accrue. Cette réponse est d’autant plus intense qu’elle survient dans un contexte de dénutrition. En postopératoire, un jeûne prolongé et les complications notamment septiques sont autant de facteurs favorisant ou aggravant la dénutrition.
La prévalence de la dénutrition en établissement de soins varie de 15 à 60 % selon les établissements et les critères utilisés. Une étude anglaise réalisée sur 500 malades d’un hôpital universitaire rapportait ainsi une prévalence de la dénutrition de 36 % en médecine interne, 27 % en chirurgie générale, 45 % en pneumologie, 39 % en chirurgie orthopédique et 43 % en gériatrie [2]. La dénutrition complique de nombreuses pathologies chroniques. Elle est en partie nosocomiale, puisque les trois quarts des malades qui séjournent plus d’une semaine en établissement de soins (ce d’autant qu’ils vont y être opérés), perdent du poids et que cette perte pondérale est d’autant plus importante que le malade est initialement dénutri et âgé [3] ou présente un cancer ou une insuffisance d’organe sévère. Parmi les cancers digestifs, une étude récente réalisée un jour donné dansdes centres de lutte contre le cancermet en évidence une prévalence de ladénutrition de 31,2 % chez les maladesayant un cancer colorectal et de49,5 % chez ceux ayant un cancer dutractus digestif supérieur [4]. Parailleurs, plus l’évaluation nutritionnelleest éloignée de l’admission, plusla probabilité de diagnostiquer unedénutrition est grande [5].
Conséquences
Le muscle squelettique est à la fois leplus grand réservoir de protéines del’organisme et le compartimentcorporel le plus touché par la dénutrition.Son atteinte est à l’origine dela plupart des conséquences de ladénutrition (tableau 1) [6]. Cettedernière a des conséquences néfasteset indépendantes en termes demorbidité et de mortalité, qui sontbien documentées pour la plupart desmaladies (chroniques surtout, maisaussi aiguës) auxquelles elle estassociée, augmentant la durée deséjour, le nombre de prescriptions etpar-là même le coût de l’hospitalisation.Dans une étude italienne de1 400 patients chirurgicaux, troisparamètres ont été associés à lasurvenue plus fréquente decomplications : la présence d’unedénutrition, un acte chirurgicalmajeur et un âge avancé [7].
Comment évaluer le risque ?
Depuis l’étude des « vétérans », on sait que tout malade ne bénéficiera pas d’un support nutritionnel périopératoire [8] et qu’il faut sélectionner les malades en fonction de leur état nutritionnel et des conséquences attendues du geste chirurgical. Le risque nutritionnel d’un acte chirurgical dépend du patient et de l’acte [9]. Il est d’abord lié au terrain et à la présence d’une dénutrition préexistante ; il est ensuite lié aux conséquences nutritionnelles de l’acte chirurgical lui-même, du fait des modifications anatomiques et/ou fonctionnelles du tube digestif qu’il entraîne (ex. : duodéno-pancréatectomie céphalique, résection intestinale étendue, gastrectomie totale, chirurgie ORL,…), mais aussi à la survenue de complications postopératoires (infections, fistules,…) qui entraînent anorexie et hypermétabolisme mais conduisent également souvent à remettre le patient à jeun. La chirurgie du reflux gastro-oesophagien, de la lithiase biliaire, de la diverticulose colique et la chirurgie du cancer colorectal non compliqué sont des exemples de chirurgies considérées comme ayant un risque faible de morbidité. Enfin, il faut aussi prendre en compte, surtout en cas de cancer, les traitements complémentaires (radiothérapie, chimiothérapie) qui vont réduire encore la prise alimentaire.
Le risque doit être évalué chez tout futur opéré (tableau 2), tout comme l’état nutritionnel (tableau 3), en suivant les recommandations IPAQSS. L’analyse de la littérature par les experts confirme la pertinence de ces dernières recommandations [9]. La mesure de l’albuminémie peut également être recommandée, surtout en cas de chirurgie majeure, avec un seuil de dénutrition (quel que soit l’âge et la pathologie) de 30 g/L, sauf pour la chirurgie digestive non oncologique où il est plus élevé (risque de lâchage de suture en deçà de 35 g/L) [10]. L’évaluation du risque et de l’état nutritionnel est de la responsabilité de l’équipe médicochirurgicale, et doit être notée dans le dossier médical. Lorsque cette évaluation n’a pas été faite en amont, elle doit être réalisée au cours de la consultation d’anesthésie.
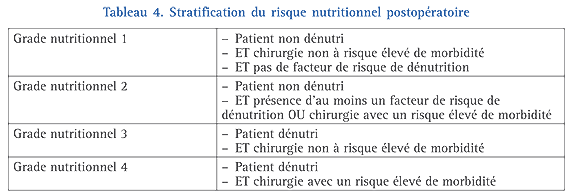
Une fois obtenues ces informations, on va prendre en compte à la fois l’état nutritionnel, les différents facteurs de risque de dénutrition périopératoire et le risque lié à l’acte chirurgical par l’établissement d’un grade nutritionnel (tableau 4) dont va dépendre la prise en charge nutritionnelle périopératoire.
Quelles preuves de l’efficacité de la nutrition préopératoire ?
Dès 1982, une étude réalisée chez 125 patients avec cancer digestif montrait le bénéfice d’une nutrition parentérale préopératoire [11]. Dans cette étude, 80 % étaient dénutris (perte de poids de plus de 5 kg et/ou albuminémie < 35 g/L). Les patients nourris avaient significativement moins de complications et une moindre mortalité (16,6 vs 4,5 %). Une large étude prospective récente a permis de confirmer que la nutrition artificielle pouvait réduire de façon significative la morbidité et la mortalité postopératoires en cas de cancers digestifs [12]. Quatre-cent-soixantehuit patients modérément ou sévèrement dénutris selon le Subjective Global Assessment étaient pris en charge pour un cancer du côlon ou de l’estomac avec intervention chirurgicale. Les patients étaient randomisés entre un groupe recevant 8 à 10 jours de nutrition préopératoire et 7 jours de nutrition postopératoire, entérale ou parentérale (le choix était laissé au clinicien en fonction du contexte) et un groupe contrôle (nutrition orale standard préopératoire et en postopératoire un apport de 600 kcal d’une solution glucido-protidique). Les complications survenaient chez 18,3%des patients recevant une nutrition artificielle contre 33,5 % dans le groupe contrôle (p = 0,012). Quatorze patients décédaient dans le groupe contrôle et 5 dans le groupe recevant une nutrition artificielle (6,0 % vs 2,1 %, p = 0,003). Ces résultats confirment la nécessité d’une nutrition artificielle pour les patients sévèrement dénutris devant bénéficier d’un geste chirurgical pour cancer digestif. Trois études prospectives ont prouvé que l’immunonutrition préopératoire, dans les cancers digestifs, réduisait de façon très significative l’incidence des complications postopératoires. La plus importante de ces études comportait 305 patients non ou moyennement dénutris (perte de poids inférieure à 10 %) avec cancers digestifs (oesophagiens, gastriques, pancréatiques et colorectaux) [13]. Les patients étaient randomisés en trois groupes : complémentation orale de 5 jours d’un mélange immunostimulant (Impact®) avant l’intervention (1 litre/jour), même complémentation préopératoire et immunonutrition postopératoire par jéjunostomie, ou aucun support nutritionnel. L’étude objectivait une réduction de 50 % des complications infectieuses postopératoires dans les deux groupes recevant une immunonutrition (30,4 % dans le groupe contrôle vs 15,8 % dans le groupe périopératoire vs 13,7 % dans le groupe préopératoire, p = 0,006 groupe contrôle vs groupe préopératoire).
Chez qui administrer un support nutritionnel ? (Tableaux 5-8)
En préopératoire d’une chirurgie digestive lourde, les patients sévèrement dénutris peuvent bénéficier (réduction de 10 % de la morbidité postopératoire) d’une nutrition artificielle préopératoire de 7 à 14 jours, à mettre en balance avec les risques de la technique de nutrition et celui de retarder l’intervention [14]. L’assistance nutritionnelle sera réalisée par voie entérale si possible avec un soluté hyperprotéiné à 25 à 30 kcal/ kg/j, dont 1,2 à 1,5 g de protéines/kg. La sonde naso-gastrique sera une sonde de 10 French en silicone ou polyuréthane, la sonde de Salem étant proscrite. Si le recours à la voie parentérale est nécessaire, celle-ci apportera 25 à 30 kcal/kg/j, dont 0,20 à 0,25 g d’azote/kg/j, avec ajout d’électrolytes (apports recommandés de 50 à 100 mmol de NaCl / 24 h + 40 à 80 mmol de KCl / 24 h), de vitamines et d’oligoéléments. Le traitement par glutamine en cas de complication se fera à la dose de 0,3 g/kg/j sans dépasser 21 jours de traitement.
En cas de dénutrition très sévère (IMC = 13, perte de poids > 20 % en 3 mois, apports oraux négligeables pendant 15 jours ou plus), la nutrition préopératoire durera au moins 21 jours et sera réalisée par voie entérale si possible, débutée à 10 kcal/kg/j en augmentant très progressivement pour atteindre les besoins en une semaine. Quelle que soit la voie d’administration, on ajoutera systématiquement par jour : thiamine (200 à 300 mg), phosphore (0,3-0,6 mmol/kg), magnésium (0,2 mmol/kg en IV-0,4 mmol/ kg per os), potassium (2-4 mmol/kg), vitamines et oligoéléments.
Le court temps (moins de dix minutes au total) passé à l’étape de classification va permettre un gain significatif de temps dans la durée de séjour du patient mais aussi dans la décision thérapeutique qui va dépendre du grade nutritionnel (GN) du patient [15]. Ces protocoles ont bénéficié des nombreux travaux réalisés dans le projet « Early Recovery After Surgery », approche multimodale dont les aspects nutritionnels comprennent la forte limitation du jeûne périopératoire et le retrait précoce de la sonde d’aspiration digestive [16]. De plus, il a été montré que la consommation d’un liquide sucré deux heures avant l’anesthésie diminue les nausées mais aussi l’insulino-résistance postopératoire [17]. Les RFE ont distingué la situation des patients diabétiques mais aussi des patients âgés de plus de 70 ans et des patients obèses [18] : chez ces derniers, tout régime amaigrissant préopératoire doit être proscrit et la prescription nutritionnelle basée sur un poids correspondant à un IMC entre 25 et 30. En cas de chirurgie oncologique digestive à risque (GN 2 et 4), l’apport d’immunonutriments pendant les sept jours précédant le geste chirurgical est recommandé, indépendamment de l’état nutritionnel (prescription sur ordonnance de médicaments ou de produits et prestations d’exception). Un apport de 1 000 kcal/j (trois briquettes par jour d’Oral Impact® (Nestlé Clinical Nutrition, Noisiel, France)) est recommandé [19]. En cas d’impossibilité d’utiliser la voie orale, l’apport entéral de ce produit est justifié.
Comment administrer le support nutritionnel ?
Les effets de la nutrition préopératoire sont jugés sur la diminution des complications qui dépend des nutriments apportés et non, en une semaine, du gain de poids. De ce fait, la nutrition peut être réalisée par voie orale (conseils diététiques et compléments nutritionnels oraux) chez une grande partie des patients. Le choix du type de support nutritionnel n’est pas spécifique à cette situation clinique (figure 1).
Si les capacités orales du patient sont insuffisantes, la voie entérale doit être choisie si elle est réaliste et permettra d’assurer l’apport nutritionnel suffisant recommandé. Il faut noter qu’après chirurgie digestive la nutrition entérale précoce n’a pas d’effet délétère sur le risque de complications anastomotiques et réduit significativement le risque de complications infectieuses et la durée de séjour d’après une métaanalyse incluant des séries de nutrition entérale et de reprise alimentaire orale [20]. Lors de la chirurgie majeure sus-mésocolique, il faut choisir en préopératoire la voie d’abord digestive (sonde supra ou transanastomotique, sonde de stomie) permettant de débuter précocement la nutrition entérale. En chirurgie oncologique ORL, en particulier lorsque la radiothérapie est également prévue, la gastrostomie préthérapeutique est probablement la technique de choix. Elle doit être posée avant le début du traitement oncologique.
La durée de la nutrition préopératoire sera adaptée au grade nutritionnel du patient, de 7 à 21 jours (tableaux 5 à 8).
Conclusion
La fréquence et la gravité de la dénutrition et les preuves de l’efficacité de la nutrition artificielle justifient que tout malade candidat à une intervention de chirurgie digestive réglée soit classé en fonction de son risque nutritionnel. Ce classement doit être fait au moins une semaine avant la date d’intervention, de façon à permettre sept jours de nutrition préopératoire, si c’est nécessaire. Cette responsabilité incombe au gastroentérologue, au chirurgien, ou à l’anesthésiste.
Références
- Chambrier C, Sztark F. Recommandations de bonnes pratiques cliniques sur la nutrition périopératoire. Actualisation 2010 de la conférence de consensus de 1994 sur la « Nutrition artificielle périopératoire en chirurgie programmée de l’adulte ». Nutr Clin Metabol 2010;24:145-56.
- McWhirter JP, Pennington CR. Incidence and recognition of malnutrition in hospital. Bmj 1994;308: 945-8.
- Weinsier RL, Hunker EM, Krumdieck CL, Butterworth CE, Jr. Hospital malnutrition. A prospective evaluation of general medical patients during the course of hospitalization. Am J Clin Nutr 1979;32:418-26.
- Pressoir M, Desne S, Berchery D, Rossignol G, Poiree B, Meslier M, et al. Prevalence, risk factors and clinical implications of malnutrition in French Comprehensive Cancer Centres. Br J Cancer 2010;102:966-71.
- Kyle UG, Schneider SM, Pirlich M, Lochs H, Hébuterne X, Pichard C. Does nutritional risk, as assessed by Nutritional Risk Index, increase during hospital stay? A multinational population-based study. Clin Nutr 2005;24:516-24.
- Stratton RJ, Green CJ, Elia M. Diseaserelated malnutrition: an evidencebased approach to treatment. Wallingford, UK; Cambridge, MA: CABI Publishing; 2003.
- Bozzetti F, Gianotti L, Braga M, Di Carlo V, Mariani L. Postoperative complications in gastrointestinal cancer patients: the joint role of the nutritional status and the nutritional support. Clin Nutr 2007;26:698-709.
- Perioperative total parenteral nutrition in surgical patients. The Veterans Affairs Total Parenteral Nutrition Cooperative Study Group. N Engl J Med 1991;325:525-32.
- Thibault R, Francon D, Eloumou S, Piquet M-A. Évaluation de l’état nutritionnel périopératoire. Nutr Clin Metabol 2010;24:157-66.
- Kingham TP, Pachter HL. Colonic anastomotic leak: risk factors, diagnosis, and treatment. J Am Coll Surg 2009;208:269-78.
- Muller JM, Brenner U, Dienst C, Pilchmaier H. Preoperative parenteral feeding in patients with gastrointestinal carcinoma. Lancet 1982;i:68-71.
- Wu GH, Liu ZH, Wu ZH, Wu ZG. Perioperative artificial nutrition in malnourished gastrointestinal cancer patients. World J Gastroenterol 2006;12:2441-4.
- Gianotti L, Braga M, Nespoli L, Radaelli G, Beneduce A, Di Carlo V. A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer. Gastroenterology 2002;122:1763-70.
- Weimann A, Braga M, Harsanyi L, Laviano A, Ljungqvist O, Soeters P, et al. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation. Clin Nutr 2006;25: 224-44.
- Senesse P, Chambrier C. Nutrition périopératoire : protocoles de soins. Nutr Clin Metabol 2010;24:210-6.
- Varadhan KK, Neal KR, Dejong CH, Fearon KC, Ljungqvist O, Lobo DN. The enhanced recovery after surgery (ERAS) pathway for patients undergoing major elective open colorectal surgery: a meta-analysis of randomized controlled trials. Clin Nutr 2010;29:434-40.
- Hausel J, Nygren J, Thorell A, Lagerkranser M, Ljungqvist O. Randomized clinical trial of the effects of oral preoperative carbohydrates on postoperative nausea and vomiting after laparoscopic cholecystectomy. Br J Surg 2005;92:415-21.
- Quilliot D, Ziegler O. Prise en charge nutritionnelle périopératoire du patient obèse. Nutr Clin Metabol 2010;24:196-205.
- Zazzo J-F. Place de la pharmaconutrition en périopératoire. Nutr Clin Metabol 2010;24:178-92.
- Lewis SJ, Egger M, Sylvester PA, Thomas S. Early enteral feeding versus “nil by mouth” after gastrointestinal surgery: systematic review and metaanalysis of controlled trials. BMJ 2001;323:773-6.
Les 4 points forts
- La dénutrition est un facteur majeur de complications postopératoires en chirurgie digestive programmée, oncologique ou non.
- Tout futur opéré doit être classé en quatre grades nutritionnels en prenant en compte :
- le risque lié au terrain (âge, comorbidité, antécédents) ;
- l’état nutritionnel (selon indice de masse corporelle, perte de poids, albuminémie) ;
- le risque de l’opération programmée ;
- les traitements concomitants.
- La durée de la nutrition préopératoire va de 7 à 21 jours.
- En cas de chirurgie digestive carcinologique, l’immunonutrition préopératoire est indiquée quel que soit l’état nutritionnel.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION







.png)